Sukinato dehydrogenáza Štruktúra, funkcia, regulácia, choroby
- 4507
- 179
- Tomáš Mydlo
SiežUccinato dehydrogenáza (SDH), tiež známy ako komplex II elektrónového transportného reťazca, je to mitochondriálny proteínový komplex s enzymatickou aktivitou, ktorý pracuje tak v Krebsovom cykle aj v reťazci elektrónového dopravníka (dýchanie buniek).
Je to enzým, ktorý je prítomný vo všetkých aeróbnych bunkách. V eukaryotoch je komplex úzko spojený s vnútornou mitochondriálnou membránou, zatiaľ čo v prokaryotoch sa nachádza v plazmatickej membráne.
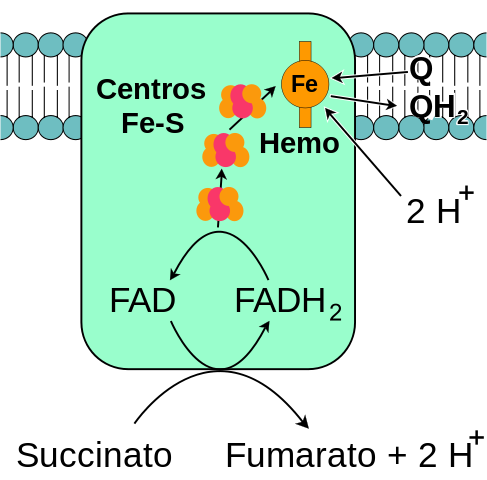 Všeobecná schéma mitochondriálneho komplexu sukcinát dehydrogenázy (zdroj: ja, založená na vektorizácii Fvasconcellos. / Verejná doména, cez Wikimedia Commons)
Všeobecná schéma mitochondriálneho komplexu sukcinát dehydrogenázy (zdroj: ja, založená na vektorizácii Fvasconcellos. / Verejná doména, cez Wikimedia Commons) Komplex sukcinátu dehydrogenázy, objavenej okolo roku 1910 a prvýkrát v roku 1954 Singer a Kearney, sa vo veľkej miere študoval z niekoľkých dôvodov:
- Funguje tak v cykle Krebs (cyklus kyseliny citrónovej alebo cyklus kyseliny trikarboxylovej), ako aj v transportnom reťazci elektrónov (katalyzuje oxidáciu sukcinátu fumarátu)
- Jeho aktivita je regulovaná rôznymi aktivátormi a inhibítormi a
- Je to komplex spojený s: železom, ktoré nie je spojené so skupinou Hemo, labylsulfur a dyukleotidmi Flavina Adenina (FAD)
Je kódovaný jadrovým genómom a bolo dokázané, že mutácie v štyroch génoch, ktoré kodifikujú každú zo svojich podjednotiek (A, B, C a D), vedú k rôznym klinickým obrázkom, to znamená, že môžu byť dosť negatívne z bodu Z pohľadu fyzickej integrity ľudských bytostí.
[TOC]
Štruktúra
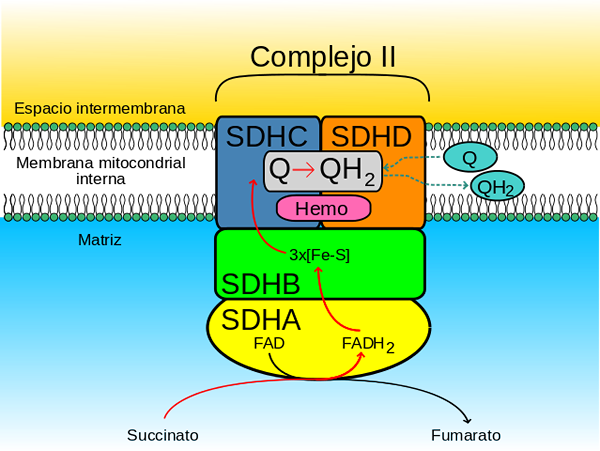
Enzýmový komplex sukcinátdehydrogenáza je tvorená štyrmi podjednotkami (heterotarámero) kódovanými jadrovým genómom, takže je jediným komplexom oxidačnej fosforylácie v reťazci elektrónového dopravníka, ktorý nemá žiadnu podjednotku kódovanú mitochondriálnym genómom.
Okrem toho je tento komplex jediný, ktorý počas katalytického pôsobenia nepočuje protóny vnútornej mitochondriálnej membrány.
Podľa štúdií založených na enzymatickom komplexe buniek srdcových buniek ošípaných, komplex sukcinátdehydrogenázy pozostáva z:
- ahlavná strana„ Hydrofilný ktorá siaha od vnútornej mitochondriálnej membrány po mitochondriálnu matricu a
- alinka„ Hydrofóbny ktorý je zabudovaný do vnútornej mitochondriálnej membrány a ktorý má malý segment, ktorý je premietaný smerom k rozpustnému intermembránovému priestoru mitochondrie
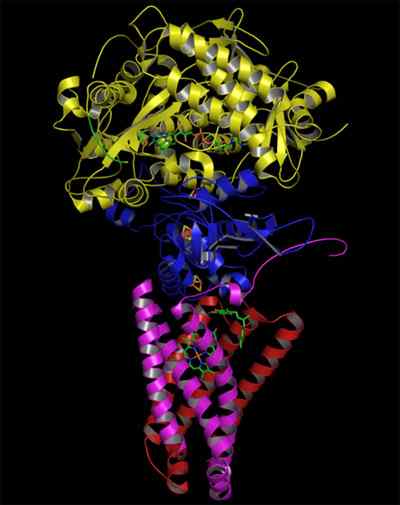
 Štruktúra komplexnej sukcinátovej dehydrogenázy (Zdroj: Zephyris v anglickom jazyku Wikipedia/CC BY-SA (http: // creativecommons.Org/licencie/By-SA/3.0/) cez Wikimedia Commons)
Štruktúra komplexnej sukcinátovej dehydrogenázy (Zdroj: Zephyris v anglickom jazyku Wikipedia/CC BY-SA (http: // creativecommons.Org/licencie/By-SA/3.0/) cez Wikimedia Commons) Štruktúra hydrofilnej časti
Hydrofilná hlava sa skladá z SDHA (70 kDa) a SDHB (27 kDa) (SDH1 a SDH2 v kvasinkách), čo zahŕňa katalytické centrum komplexu.
Podjednotky SDHA a SDHB obsahujú redoxné kofaktory zúčastňujúce sa na prenose elektrónov do ubikinónu (Coenzým Q10, molekula, ktorá transportuje elektróny medzi dýchacími komplexmi I, II a III).
Podjednotka SDHA má kofaktor FAD (koenzým, ktorý sa podieľa na oxid-redukčných reakciách) spolu s jej štruktúrou, práve v mieste spojenia sukcinátu (hlavný substrát enzýmu).
Podjednotka SDHB má 3 strediská železa-cukru (FE-S), ktoré sprostredkujú prenos elektrónov do ubichinónu. Jeden z centier, 2FE-2S, sa nachádza v blízkosti miesta podjednotky SDHA a ostatné (4FE-4S a 3FE-4S) priliehajú k prvému.
Môže vám slúžiť: fylogéniaJe potrebné poznamenať, že štrukturálne štúdie naznačujú, že podjednotka SDHB tvorí rozhranie medzi hydrofilnou katalytickou doménou a doménou „kotvy“ k membráne (hydrofóbnej) komplexu.
Štruktúra hydrofóbnej časti
Membránska doména komplexu, ako je uvedené, pozostáva z SDHC (15 kDa) a SDHD (12-13 kDa) (SDH3 a SDH4 v kvasinkách), ktoré sú tvorené komplexnými proteínmi membránových proteínov, každý, každý, 3 transmembranskými propermi.
Táto doména obsahuje časť hemo b spojené v rozhraní medzi podjednotkami SDHC a SDHD, kde každý z dvoch histidínových ligandov, ktoré ich udržiavajú pohromade.
V tomto enzýme boli zistené dve únie pre ubichinonu: jedna z veľkých afinity a jedna z nízkej afinity.
Miesto vysokej afinity, známe ako QP (P By proximálny) Je tvárou voči mitochondriálnej matrici a je tvorená špecifickými zvyškami aminokyselín umiestnených v podjednotkách SDHB, SDHC a SDHD.
Stránka s nízkou afinitou, ktorá sa tiež nazýva QD (D by distálny) Je to v časti vnútornej mitochondriálnej membrány, kde je komplex vložený, bližšie k intermembránovému priestoru, to znamená ďalej od organovej matrice.
Celkový komplex má spoločne molekulovú hmotnosť blízko 200 kDa a zistilo sa, že má pomer 4.2-5.0 flavin nanomolov na miligram proteínu a 2-4 g železa pre každú mol flaviny.
Funkcia
Enzymatický sukcinát komplex dehydrogenázy plní dôležitú funkciu v mitochondriách, pretože sa nezúčastňuje nielen na cykle Krebs (kde sa podieľa na degradácii acetyl -CoA), ale tiež súčasťou respiračného reťazca, základný pre výrobu energie ATP.
Inými slovami, je to kľúčový enzým pre sprostredkovateľský metabolizmus a aeróbnu výrobu ATP.
- Je zodpovedný za oxidáciu sukcinátu fumarátu v cykle kyseliny citrónovej
- Kŕmi komplex III elektrónového dopravného reťazca elektrónmi odvodenými od oxidácie sukcinátu, čo pomáha znižovať kyslík a tvoriť vodu
- Elektrónový transport vytvára elektrochemický gradient cez vnútornú mitochondriálnu membránu, ktorá uprednostňuje syntézu ATP
Ako alternatívu sa elektróny môžu použiť na zníženie molekúl z „bazénu“ ubichinonasu, čím sa vytvoria potrebné reduktory na zníženie superoxidových aniónov, ktoré pochádzajú z rovnakého respiračného reťazca alebo ktoré pochádzajú z exogénnych zdrojov.
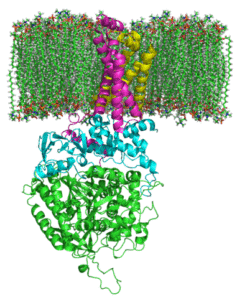
 Sukcinát komplex Degidrogenasa (zdroj: Johnhfst / verejná doména, cez Wikimedia Commons)
Sukcinát komplex Degidrogenasa (zdroj: Johnhfst / verejná doména, cez Wikimedia Commons) Ako to koná?
Podjednotka A komplexu (ktorý je kovalentne spojený s výstrelom koenzýmu) sa spája s substrátmi, fumarát a sukcinácia, ako aj jeho fyziologické regulátory, oxalacetát (konkurenčný inhibítor) a ATPPP.
ATP vytlačí spojenie medzi oxalacetátom a komplexom SDH a potom sa elektróny, ktoré sú „minulé“ od sukcinátu k podjednotke SDHA.
Môže vám slúžiť: myosín: Charakteristiky, štruktúra, typy a funkciaZ podjednotky B tieto elektróny dosahujú hemmo lokality b z podjednotiek SDHC a SDHD, odkiaľ sú „doručené“ Quinonas Coenzýmom cez ich úniové miesta do Quinonas.
Elektronický tok zo sukcinátu cez tieto transportéry a dokonca aj konečný akceptor, ktorým je kyslík, je spojený so syntézou 1.5 molekúl ATP pre každý elektronický krútiaci moment prostredníctvom fosforylácie respiračného reťazca.
Defekty Inzima
Uvádza sa, že mutácie v géne, ktoré kódujú podjednotku komplexnej sukcinátovej dehydrogenázy.
Regulácia
Aktivita komplexnej sukcinátovej dehydrogenázy môže byť regulovaná post -translačnými modifikáciami, ako je napríklad fosforylácia a acetylácia, Aj keď sa môže vyskytnúť aj inhibícia aktívnej lokality.
Acetylácia niektorých lyzínových odpadov môže znížiť aktivitu tohto enzýmu a tento proces sa vykonáva enzýmom acetylázy známeho ako SIRT3; Fosforylácia má rovnaký účinok na enzým.
Okrem týchto modifikácií je komplex SDH tiež regulovaný sprostredkovateľmi cyklu Krebs, konkrétne Oxalacetát a utraviť. Oxalacetát je silný inhibítor, zatiaľ čo sukcinuje uprednostňuje disociáciu oxalacetátu a funguje ako aktivátor.
Impulzná dehydrogenáza
Dehydrogenáza sukcinátu je porucha anomálie alebo mitochondriálneho respiračného reťazca. Tento nedostatok je spôsobený mutáciami SDHA (alebo SDHAF1), SDHB, SDHC a SDHD.
Rôzne vyšetrovania preukázali homozygotné a heterozygotné mutácie v týchto génoch, najmä SDHA. Mutácie týchto génov spôsobujú aminokyselinové substitúcie v proteíne (v ktorejkoľvek z SDHA, B, C alebo D) alebo zlyhávajú s kodifikáciou abnormálne krátkych proteínov.
Preto substitúcie aminokyselín a abnormálne krátke kódovanie proteínov spôsobujú poruchy alebo zmeny enzýmu SDH, ktoré spôsobujú zlyhanie optimálnej kapacity mitochondrií produkovať energiu. To je to, čo vedci nazývajú porucha mitochondriálneho dýchacieho reťazca.
Táto porucha sa dá vyjadriť v ľudskej bytosti fenotypom mnohými spôsobmi. Najznámejšie sú: nedostatok alebo nedostatok lingvistického vývoja, spastické kvadruplex, svalové nedobrovoľné kontrakcie (dystónia), svalová slabosť a myokardiopatia, okrem iných súvisiacich problémov.
Niektorí pacienti s dehydrogenázou sukcinátu môžu prejaviť Leightovu chorobu alebo Kearns-Saire Syndróm.
Ako sa zistí dehydrogovaný nedostatok sukcinátu?
Niektoré štúdie naznačujú použitie kvalitatívnych testov a analýzy, ako aj kvantitatívne, enzymatické biochemické analýzy respiračného reťazca. Iní na druhej strane naznačujú úplnú expanziu polymerázou reťazovej reakcie (PCR) exónov podjednotiek študovaných a potom príslušného sekvenovania.
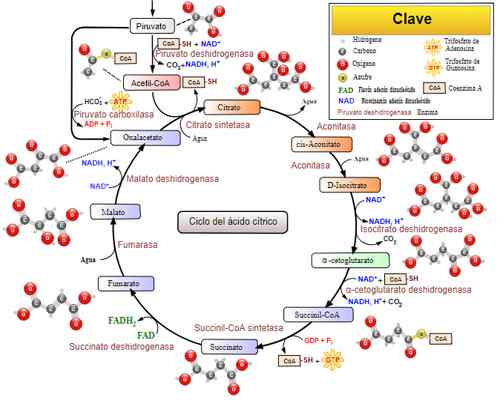 Cyklus kyseliny trikarboxylovej (cyklus Krebs). Prevzaté a upravené z: Narayanese, Wikiuserpedia, Yassinemrabet, Totobaggins (preložené do španielčiny Alejandro Porto) [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)].
Cyklus kyseliny trikarboxylovej (cyklus Krebs). Prevzaté a upravené z: Narayanese, Wikiuserpedia, Yassinemrabet, Totobaggins (preložené do španielčiny Alejandro Porto) [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Súvisiace choroby
Existuje veľa fenotypových expresií vyvolaných poruchami mitochondriálneho respiračného reťazca v dôsledku sukcinátu dehydrogenázy sukcinátu. Avšak, keď ide o syndrómy alebo choroby, hovorí sa o nasledujúcich.
Môže vám slúžiť: 8 najdôležitejších biogeochemických cyklov (popis)Syndróm
Je to progresívne neurologické ochorenie spojené s mutáciami v jadrovom genóme (v tomto prípade sukcinátu dehydrogenázy), ktoré ovplyvňujú komplex pyruvát-dishydrogenázy k oxidačnej fosforylačnej ceste.
Príznaky sa objavujú pred prvým rokom jednotlivca, ale v atypických prípadoch boli pozorované prvé príznaky počas dospievania.
Medzi najbežnejšie pozorované príznaky patria: hypotónie so stratou cefalickej kontroly, nedobrovoľné pohyby, opakujúce sa zvracanie, respiračné problémy, neschopnosť presúvať očné krvinky, pyramídu a extrapiramidálne príznaky. Záchvaty nie sú veľmi bežné.
Je možné, že ochorenie sa dá zistiť pri prenatálnych diagnózach. Špecifická liečba alebo liečba nie je známa, ale niektorí odborníci navrhujú ošetrenie určitým vitamínom alebo kofaktorom.
Nádor gastrointestinálneho strómu (GIST)
Bežne nazývaná GIST je to typ nádoru gastrointestinálneho traktu, ktorý sa vo všeobecnosti vyvíja v oblastiach ako žalúdok alebo tenké črevo. Predpokladá sa, že ich príčina je spôsobená určitou skupinou vysoko špecializovaných buniek nazývaných ICC bunky alebo intersticiálne bunky Cajal.
Ďalšími úvahami o príčine GIST sú mutácie určitých typov génov, ktoré podľa niektorých autorov spôsobujú 90% nádorov. Zúčastnené gény sú: Kit, gény pdgfra, sukcinát dehydrogenázy (SDH) - zlé.
Sukcinát dehydrogenáza (SDH) - chudobná, sa vyskytuje hlavne u mladých žien, produkuje nádory žalúdka a relatívna frekvencia produkuje metastázy v lymfatických uzlinách. K deťom sa vyskytuje malé percento a vo väčšine prípadov je to kvôli nedostatku expresie podjednotky SDHB.
Syndróm Kearns-Sayre
Zistilo sa, že niektorí pacienti s nedostatkom sukcinátu dehydrogenázy môžu prejaviť Kearns-Sayreov syndróm. Toto ochorenie súvisí s mitochondriálnymi poruchami a vyznačuje sa absenciou pohybu očných balónov.
Ďalšími charakteristikami tohto ochorenia sú pigmentárna retinitída, hluchota, kardiomyopatia a stavy centrálneho nervového systému. Zvyčajne sa tieto príznaky pozorujú skôr, ako sa pacient otočí 20 rokov. Nie je známa prenatálna diagnostika pre tento stav.
Pre túto chorobu nie je vyliečená. Liečba je paliatívna, to znamená, že iba znižuje účinky choroby, nie na liek. Na druhej strane, aj keď to závisí od počtu postihnutých orgánov a od dostupnej lekárskej starostlivosti, dĺžka života je relatívne normálna.
Odkazy
- Ackrell, B. Do., Kearney, e. B., & Singer, T. P. (1978). [47] cicavčie sukcinát dehydrogenázy. V metódach v enzymológii (zv. 53, pp. 466-483). Akademická tlač.
- Brère, J. J., Favier, J., Ghouzzi, v. A., Djoudi, f., Benit, P., Gimenez, a. P., & Rustin, P. (2005). Sukcinát dehydrogenázovej deficity u človeka. Bunkové a molekulárne vedy o živote CMLS, 62 (19-20), 2317-2324.
- Cecchini, G., Schröder, i., Gunalus, r. P., & Maklashina a. (2002). Sukcinát dehydrogenázy a fumate redactázy z Escherichia coli. Biochimica et Biophysica Acta (BBA) -bioenergetics, 1553 (1-2), 140-157.
- Nenávisť a., & Davis, K. Do. (1971). Sukcinát dehydrogenázy. Jo. Čistenie, molekulárne vlastnosti a subštruktúra. Biochemistry, 10 (13), 2509-2516.
- Hederstedt, l. Do. R. Siež., & Rutberg, L. Do. R. Siež. (1981). Sukcinát dehydrogenázy-A porovnávacie preskúmanie. Microbiological Reviews, 45 (4), 542.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger princípy biochémie. Macmillan.
- Rutter, J., Winge, D. R., & Schiffman, J. D. (2010). Sukcinát dehydrogenázy-zostavy, regulácia a úloha v ľudskom diew. Mithochondrion, 10 (4), 393-401.
- « Funkcie esenciálnych mastných kyselín, dôležitosť, nomenklatúra, príklady
- Pravidlo T, aby slúžilo, príklady »

