Koncept, proces, proces a príklady progresívnej sublimácie
- 2237
- 408
- Tomáš Mydlo
Ten progresívna sublimácia Je to termodynamický proces, pri ktorom sa zmena endotermického stavu vyskytuje priamo z pevnej látky na plyn, bez predchádzajúcej tvorby kvapaliny. Správanie tuhej látky za normálnych podmienok je zahrievanie a roztavenie; to znamená, že topí. Medzitým pri sublimácii začína tuhá látka fajčiť priamo, bez predchádzajúceho vzhľadu kvapiek, ktoré naznačujú jeho obsadenie.
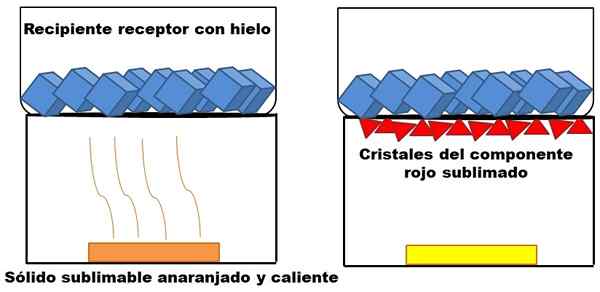
To, čo je opísané v hornom odseku, je znázornené v nadradenom obrázku. Predpokladajme, že pomarančová tuhá zmes (vľavo), ktorá sa začne zahrievať. Zmes sa skladá z dvoch komponentov alebo tuhých látok: jedna žltá a druhá červená, ktorej kombinácia spôsobuje oranžovú farbu.
 Príklad sublimácie hypotetickej pomarančovej pevnej látky. Zdroj: Gabriel Bolívar.
Príklad sublimácie hypotetickej pomarančovej pevnej látky. Zdroj: Gabriel Bolívar. Sublimálna červená tuhá látka, pretože jej kvapalina sa nevytvára, ale končí uložená (červené trojuholníky) v spodnej časti hornej nádoby; Ten, ktorý obsahuje kocky ľadu, a preto ponúka studený povrch. Medzitým žltá tuhá látka zostáva nezmenená teplotou (žltý obdĺžnik).
Červené trojuholníky alebo kryštály sa ukladajú vďaka studenému povrchu prijímajúceho nádoby (vpravo), ktorý absorbuje jeho teplotu; A aj keď nie je znázornené, veľkosť jeho kocky ľadu sa musí v dôsledku absorpcie tepla znížiť. Žltá pevná látka nie je sublimovateľná, a ak sa ešte skôr alebo neskôr zaharil, topí sa.
[TOC]
Koncept progresívnej sublimácie
Spracovanie
Už sa hovorí, že sublimácia je endotermická zmena stavu, pretože na to musí dôjsť k absorpcii tepla. Ak tuhá látka absorbuje teplo, jeho energia sa zvýši, takže jej častice budú tiež vibrovať pri vyšších frekvenciách.
Keď sa tieto vibrácie stanú veľmi silnými, nakoniec ovplyvňujú intermolekulárne interakcie (nie kovalentné väzby); A preto skôr alebo neskôr budú častice od seba navzájom viac vzdialenosti.
Môže vám slúžiť: kryštalizáciaV niektorých tuhých látkach sú vibrácie také silné, že niektoré častice sú „spustené“ mimo štruktúry namiesto aglomerácie v mobilných klastroch, ktoré definujú kvapku. Tieto častice unikajú a integrujú prvú „bublinu“, ktorá by radšej vznikla prvé výpary sublimovanej tuhej látky.
Potom sa nehovorí o bode topenia, ale o sublimácii. Zatiaľ čo obidve sú závislé od vládnuceho tlaku na pevnú látku, bod sublimácie je viac; Preto sa jej teplota výrazne mení so zmenami tlaku (ako je to v prípade bodu varu).
Od pevnej štruktúry po poruchu plynu
Pri sublimácii sa tiež hovorí, že dochádza k zvýšeniu entropie systému. Energetické stavy častíc prechádzajú z obmedzenia ich pevných pozícií v pevnej štruktúre, na homogenizovanie v ich rozmarných a chaotických smeroch v plynnom stave, rovnomernejšie, kde konečne získajú priemernú kinetickú energiu.
Fázový diagram a trojitý bod
Bod sublimácie závisí od tlaku; Pretože inak by tuhé častice absorbovali teplo, aby sa nevystrelili do priestoru mimo tuhej látky, ale na vytvorenie kvapiek. Nebolo by to sublimované, ale roztopilo by sa to, ako je to najbežnejšie.
Čím väčší je vonkajší tlak, tým menej bude pravdepodobné.
Ale ktoré tuhé látky sú subjektívne a ktoré nie? Odpoveď spočíva vo vašich fázach fáz P vs T, ako je uvedené nižšie:
Môže vám slúžiť: Plavba pre tégliku: Charakteristiky, funkcie, použite príklady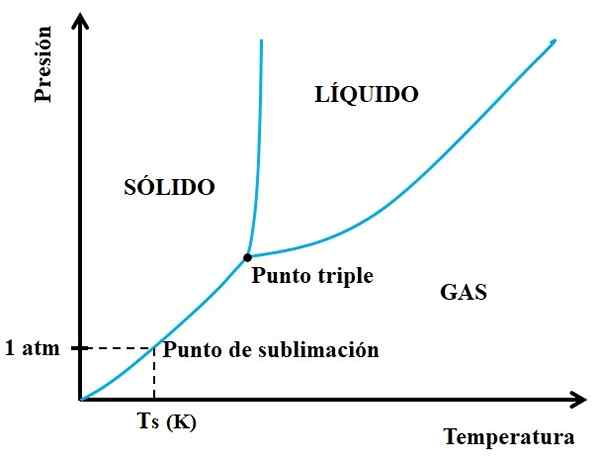 Fázový diagram pre hypotetickú látku. Zdroj: Gabriel Bolívar.
Fázový diagram pre hypotetickú látku. Zdroj: Gabriel Bolívar. Najprv sa musíte pozrieť na trojnásobný bod a cestovať na spodnom úseku: ten, ktorý oddeľuje pevné a plynné stavy. Všimnite si, že v pevnej oblasti musí dôjsť k zníženiu tlaku, aby sa vyskytla sublimácia (nie nevyhnutne 1 atmosférický tlak). 1 bankom.
Čím dlhšie a dlhšie je sekcia alebo krivka pod trojnásobným bodom, tým väčšia je kapacita pevnej látky sublimov pri rôznych teplotách; Ale ak je výrazne pod 1 bankomat, bude potrebný s vysokými medzerami na dosiahnutie sublimácie, aby sa tlaky znížili (napríklad 0,0001 atm).
Podmienky
Ak je trojitý bod tisíckrát nižší ako atmosférický tlak, tuhá látka nikdy nebude sublimovaná alebo dokonca uplatňovať ultra životný život (nehovoriac o jeho náchylnosti na rozklad pôsobením tepla).
Ak tomu tak nie je, sublimácie sa vykonávajú mierne a predkladajú pevnú látku na vákuum, aby ich častice ľahšie unikli, bez potreby absorbovania toľko tepla.
Sublimácia sa stáva veľmi dôležitou, keď sú obzvlášť pevné látky s vysokým tlakom pary; to znamená tlak vo vnútri, odraz efektívnosti jeho interakcií. Čím väčší je jeho tlak pary, tým zápach je a je tiež viac subjektívny.
Príklady
Pevné čistenie
Obrázok oranžovej pevnej látky a jej podgrifikovateľnej červenkastej komponentu je príkladom toho, čo sublimácia predstavuje týkajúce sa tuhého čistenia. Červené trojuholníky sa dajú znovu zabezpečiť toľkokrát, koľkokrát je potrebné, kým nebude zaručená vysoká čistota.
Môže vám slúžiť: alkoholyTáto technika sa používa hlavne s voňavými tuhými látkami. Napríklad: Káfor, kofeín, benzoín a mentol.
Medzi ďalšie tuhé látky, ktoré môžu zdôrazniť sublimáciu, máme: jód, ľad (vo veľkých nadmorských výškach), theobromín (čokoláda), sacharín, morfín a iné liečivá, dusíkové bázy a antracén.
Syntéza kryštálov
Po návrate do červených trojuholníkov ponúka sublimácia alternatívu ku konvenčnej kryštalizácii; Kryštály už nebudú syntetizované z roztoku, ale pomocou.
Povedzme, že ak majú červené štvorce, rast kryštálov si zachová túto geometriu a nemala by sa stať trojuholníkom. Červené štvorce budú postupne rásť, keď dôjde k sublimácii. Je to však operatívny a molekulárne komplexný komplex, v ktorom je pozorovaných veľa zúčastnených premenných.
Príklady syntetizovaných kryštálov sublimáciou sú: karbid kremíka (sic), grafit, arzén, selén, fosfor, hliníkový nitruro (ALN), sulfid kadmia (CDS), zinok seleniuro (ZnSE), ortuťový iodid (hgi)2), grafén, okrem iného.
Všimnite si, že sú to skutočne dva kladené javy: progresívna sublimácia a depozícia (alebo spätná sublimácia); Para emigruje z pevnej do chladnejších oblastí alebo povrchov, aby sa konečne uložili vo forme kryštálov.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2019). Sublimácia (fázový prechod). Zdroj: In.Wikipedia.orgán
- Jones, Andrew Zimmerman. (27. januára 2019). Sublimácia. Zotavené z: Thoughtco.com
- Sheila Morrissey. (2019). Čo je sublimácia v chémii? - Definícia, proces a skúšky. Štúdium. Získané z: štúdie.com
- Elsevier B.Vložka. (2019). Metóda sublimácie. Vedecký. Zdroj: ScienceDirect.com
- « Pôvod flogistickej teórie, princípy a námietky
- Sociálny rozmer je človek, vzdelávanie, vedomosti, právo, zdravie »

