Rozpustenie
- 1983
- 165
- Mgr. Pravoslav Mokroš
Čo je solvacia?
Ten Rozpustenie Je to fyzikálne a chemické spojenie medzi časticami rozpusteného a rozpúšťadla v roztoku. Líši sa od konceptu rozpustnosti v skutočnosti, že neexistuje termodynamická rovnováha medzi pevnou látkou a jej rozpustenými časticami.
Táto únia je zodpovedná za rozpustené pevné látky „zmiznú“ vzhľadom na divákov; Keď sa v skutočnosti stanú častice veľmi malé a skončia „zabalené“ listami molekúl rozpúšťadla, čo ich znemožňuje ich pozorovať.

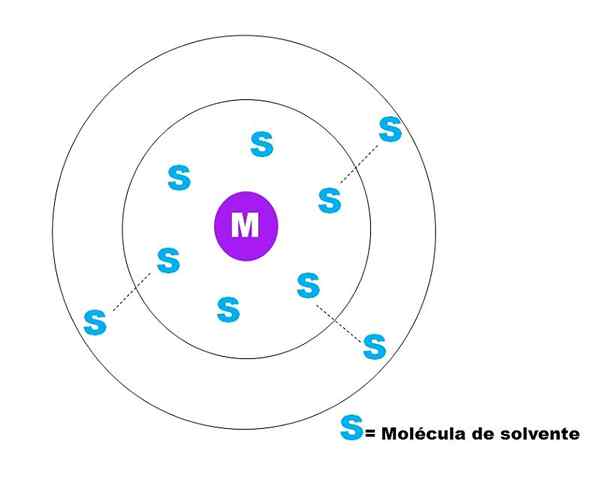
Na hornom obrázku je reprezentovaný veľmi všeobecný náčrt solvatácie častíc M. M môže byť v poriadku (m+) alebo molekula; A S je molekula rozpúšťadla, ktorá môže byť akákoľvek zlúčenina v kvapalnom stave (hoci môže byť tiež plyn).
Všimnite si, že m je obklopený šiestimi s, ktoré tvoria to, čo je známe ako Primárna solvatačná guľa. Ostatné M molekuly vo vyššej vzdialenosti interagujú van der Waalsovými silami s prvými, tvoriacimi sekundárnu riešenú guľu, atď.
Proces solvatácie
 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Molekulárne, aký je proces solvaácie? Horný obrázok sumarizuje potrebné kroky.
Molekuly rozpúšťadla, modré, sa spočiatku nariaďujú, aby vzájomne pôsobili (S-S); A častice (ióny alebo molekuly) rozpustenej látky, fialové, robia to isté so silnými alebo slabými interakciami M-M.
Aby sa vyskytla solvatácia, musí sa rozširovať rozpúšťadlo aj rozpustená látka (druhá čierna šípka), aby sa umožnilo interakcie rozpusteného rozpúšťadla (M-S).
To nevyhnutne znamená zníženie interakcií rozpusteného rozpúšťadla a rozpúšťadla; zníženie, ktoré vyžaduje energiu, a preto je tento prvý krok endotermický.
Akonáhle sa rozpustená rozpúšťadlo a rozpúšťadlo molekulárne rozšírili, mix aj výmenné miesta vo vesmíre. Každý fialový kruh druhého obrázka sa dá porovnať s kruhom prvého obrázka.
Môže vám slúžiť: vápnik: Vlastnosti, štruktúra, získanie, používanieZmena stupňa usporiadania častíc môže byť podrobne uvedená na obrázku; Objednal sa na začiatku a na konci chaotický. V dôsledku toho je posledný krok exotermický, pretože tvorba nových interakcií stabilizuje všetky častice roztoku.
Energetické aspekty
Za procesom solvaácie je potrebné zohľadniť veľa energetických aspektov. Po prvé: Interakcie S-S, M-M a M-S.
Keď interakcie M-S, tj medzi rozpúšťadlom a rozpúšťadlom, sú oveľa lepšie (silné a stabilné) v porovnaní s interakciami jednotlivých zložiek, hovorí sa o procese exotermického riešenia; A preto sa energia uvoľňuje do životného prostredia, ktoré je možné overiť meraním zvýšenia teploty pomocou teplomeru.
Ak sú naopak interakcie M-M a S-S silnejšie ako M-S, potom „rozšírenie“ bude potrebovať viac energie ako tá, ktorú zarobia, keď solvatácia vyvrcholí.
Potom sa hovorí o procese endotermického riešenia. Keďže v tomto prípade dochádza k poklesu teploty alebo to, čo je rovnaké, okolie je chladné.
Existujú dva základné faktory, ktoré vládnu, či sa rozpustenie rozpustí v rozpúšťadle. Prvým je zmena roztoku rozpustenia (AHDisk), Ako je vysvetlené, a druhým je zmena entropie (AS) medzi rozpustenou látkou a rozpustenou rozpustenou. Všeobecne platí, že AS je spojená so zvýšením poruchy aj vyššie uvedeného.
Intermolekulárne interakcie
Uviedlo sa, že solvatácia je výsledkom fyzikálneho a chemického zväzku medzi rozpúšťadlom a rozpúšťadlom; Ako presne sú tieto interakcie alebo odbory?
Ak je rozpustená látka ión, m+, Vyrábajú sa takzvané iónové depolo interakcie (M+-S); A ak ide o molekulu, potom budú existovať interakcie dipólov-dipolo alebo londýnske disperzné sily.
Môže vám slúžiť: cyklohexán: štruktúra, použitie, konformácieKeď hovoríme o interakciách Dipolo-Dippolo, hovorí sa, že v M a S je trvalý dipólový moment. Oblasť bohatá na elektróny A- M interaguje so zlá oblasť elektrónu A+ S. Výsledkom všetkých týchto interakcií je tvorba niekoľkých guľôčok solvatácie okolo M.
Okrem toho existujú aj iné typy interakcií: koordinatívna. Tu molekuly koordinačných spojení S (alebo Dative) s M, ktoré tvoria rôzne geometrie.
Základné pravidlo na zapamätanie a predpovedanie príbuznosti medzi rozpúšťadlom a rozpúšťadlom je: Rovnako sa rozpustí rovnocenné. Preto sa polárne látky rozpúšťajú s rozpúšťadlami rovnako polárne; a apolárne látky sa rozpúšťajú v apolárnych rozpúšťadlách.
Rozdiely medzi solvatáciou a hydratáciou
 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Ako sa líši riešenie hydratácie? Dva rovnaké procesy, s výnimkou toho, že S S prvého obrázka sú nahradené procesmi vody, H-O-H.
Na vynikajúcom obrázku môžete vidieť katión m+ obklopený šiestimi h molekulami2Ani. Všimnite si, že atómy kyslíka (červené) sú nasmerované na pozitívne zaťaženie, pretože je to najviac elektronegatívna, a preto má najväčšiu negatívnu hustotu δ-.
Za prvou guľou hydratácie sú ďalšie molekuly vody zoskupené okolo vodíkových mostov (OH2-Oh2). Jedná sa o interakcie typu iónov-dipolo. Molekuly vody však môžu tiež tvoriť koordinačné väzby s pozitívnym centrom, najmä ak sú kovové.
Teda slávny Aquocomplejos, m (OH2)n. Ako n = 6 na obrázku je šesť molekúl orientovaných okolo M v oktadroni koordinácie (vnútorná guľa hydratácie). V závislosti od veľkosti m+, Rozsah jeho zaťaženia a jeho elektronická dostupnosť, uviedla, že guľa môže byť menšia alebo väčšia.
Môže vám slúžiť: chrómový oxid (iii): Štruktúra, nomenklatúra, vlastnosti, použitiaVoda je pravdepodobne najprekvapivejším rozpúšťadlom zo všetkých: rozpúšťa sa nezmerateľné množstvo rozpustených látok, je to rozpúšťadlo príliš polárne a má abnormálne vysokú dielektrickú konštantu (78.5 k).
Príklady riešenia
Nižšie sú uvedené tri príklady solvatácie vo vode.
Chlorid vápenatý
Pri rozpustení chloridu vápenatého vo vode sa teplo uvoľní, keď sa vyriešia katióny2+ a cl anióny-. CA2+ Je obklopený množstvom molekúl vody rovnajúcich sa alebo viac ako šesť (CA2+-Oh2).
Tiež CL- Je obklopený atómami vodíka, oblasti δ+ vody (CL--H2Buď). Uvoľnené teplo sa môže použiť na topenie ľadov.
Močovina
V prípade močoviny je to organická molekula so štruktúrou H2N-co-NH2. Pri riešení, H molekuly2O tvoria vodíkové mosty s dvoma amingovými skupinami (-NH2-Oh2) a so skupinou karbonyl (c = o- h2Buď). Tieto interakcie sú zodpovedné za svoju veľkú rozpustnosť vo vode.
Jeho rozpustenie je tiež endotermické, to znamená, že ochladzuje nádobu na vodu, kam sa pridá.
Dusičnan amónny
Dusičnan amónny, podobne ako močovina, je rozpustenie, ktorá ochladzuje rozpustenie po solvatácii jeho iónov. NH4+ Solvata podobne ako CA2+, Aj keď pravdepodobne preto, že ide o tetraedrálnu geometriu, má menej molekuly H2Alebo okolo neho; A nie3- Solvata rovnakým spôsobom ako CL anióny- (Oh2-Ani2Žiadne h2Buď).
Odkazy
- Whitten, Davis, Peck & Stanley. Chémia. (8. vydanie.). Učenie sa.
- Belford R. (s.F.). Procesné procesy. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Surfovanie. (s.F.). Proces solvatácie. Zdroj: Surfgupy.com

