Koncentrovaný roztok
- 4348
- 1119
- Adrián Fajnor
Čo je koncentrovaný roztok?
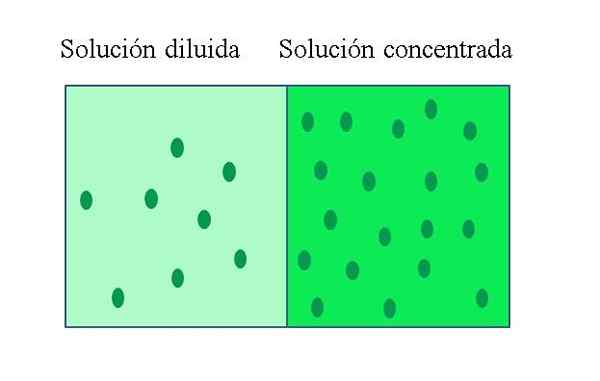
A koncentrovaný roztok Je to, čo obsahuje veľké množstvo rozpustenej látky vo vzťahu k množstvu, ktoré by mohla rozpustiť. Naopak, zriedený roztok má nízku koncentráciu rozpustenej látky. Zriedený roztok sa môže pripraviť z koncentrovaného roztoku pridaním rozpúšťadla alebo ak je to možné, extrahovanie rozpustenej látky.
Koncept môže byť relatívny, pretože to, čo definuje koncentrované roztok, sú vysoké hodnoty v niektorých jeho vlastnostiach; Napríklad pusinka Mantecado má vysokú koncentráciu cukru, čo je dokázané jej sladkou chuťou.
 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Koncentrácia rozpusteného rozsahu koncentrovaného roztoku je blízko alebo rovná koncentrácii v nasýtenom roztoku. Hlavnou charakteristikou nasýteného roztoku je to, že pri určitej teplote nemôže rozpustiť ďalšie množstvo rozpustenej látky. Preto koncentrácia rozpustenej látky v jej nasýtených roztokoch zostáva konštantná.
Rozpustnosť, väčšiny rozpustených látok, sa zvyšuje so zvyšovaním teploty. Týmto spôsobom môžete v nasýtenom roztoku solubilizovať ďalšie množstvo rozpustenej látky.
Potom znížením teploty sa zvýši koncentrácia rozpusteného roztoku nasýteného roztoku. Hovorí sa o tomto prípade presýteného roztoku.
Charakteristika koncentrovaného roztoku
Koncentrácia roztoku, to znamená vzťah medzi množstvom rozpustenej látky a množstvom roztoku alebo rozpúšťadla, sa dá vyjadriť ako percento rozpustenej látky v roztoku (P/V alebo P/P).
Môže sa tiež exprimovať v móloch z rozpustenej látky na liter roztoku (molarita) a ekvivalentov rozpustených látok na liter roztoku (normalita).
Je tiež bežné exprimovať koncentráciu roztoku v móloch rozpustenej látky na kilogram rozpúšťadla (molealita) alebo ho exprimovať v móloch rozpustenej látky vo vzťahu k celkovým mólom roztoku (molárna frakcia). V zriedených roztokoch je bežné nájsť koncentráciu roztoku v P.p.m. (časti na milión).
Môže vám slúžiť: viskozita: príklady, príčiny, jednotky, typyBez ohľadu na formu expresie koncentrácie roztoku, koncentrovaný roztok má vysoký podiel rozpustenej látky, v tomto prípade vyjadreným ako hmotnosť vo vzťahu k hmotnosti alebo objemu roztoku alebo rozpúšťadla. Byť táto koncentrácia rovná rozpustnosti rozpustenej látky v rozpúšťadle alebo veľmi blízko k jeho hodnote.
Koligatívne vlastnosti riešení
Sú to skupina vlastností roztokov, ktoré závisia od počtu častíc v roztoku bez ohľadu na jeho typ.
Koligatívne vlastnosti nerozlišujú medzi charakteristikami častíc, ak ide o sodík, chlór, glukózu atď. Dôležitá vec je vaše číslo.
Z tohto dôvodu bolo potrebné vytvoriť iný spôsob vyjadrenia koncentrácie roztoku, ktorý sa týka takzvaných koligatívnych vlastností. V reakcii na to boli vytvorené výrazy osmolarity a osmolality.
Osmolarita a osmolalita
Osmolarita súvisí s molaritou roztoku a osmolality s jeho moliálnosťou.
Jednotky osmolarity sú OSM/L roztok alebo MOSM/L roztoku. Zatiaľ čo jednotky osmolality sú OSM/kg vody alebo mosm/kg vody.
Osmolarita = mvg
M = molarita roztoku.
v = počet častíc, v ktorých sa zlúčenina vo vodnom roztoku oddeľuje. Napríklad: pre NaCl má V hodnotu 2; Pre CACL2, V má hodnotu 3 a pre glukózu, neelektrolytickú zlúčeninu, ktorá sa nerozlišuje, V má hodnotu 1.
g = osmotický koeficient, korekčný faktor pre interakciu elektricky nabitých častíc v roztoku. Tento korekčný faktor má hodnotu blízko 1 pre zriedené roztoky a má tendenciu nulu, keď sa molarita elektrolytickej zlúčeniny zvyšuje.
Môže vám slúžiť: laboratórna malta: Charakteristiky, funkcie, použitieKoligatívne vlastnosti sú uvedené nižšie, ktoré umožňujú určiť, do akej miery je roztok koncentrovaný.
Pokles tlaku pary
Keď sa voda zahrieva, odparuje sa a tvorená para vyvíja tlak. Keď sa pridá soluto, tlak pary klesá.
Koncentrované roztoky majú preto nízky tlak pary. Vysvetlenie je, že molekuly rozpustených látok sa pohybujú do molekúl vody v rozhraní Agua-Aire.
Krioskopický bod
Keď osmolarita roztoku zvyšuje teplotu, pri ktorej je vodný roztok zmrazený. Ak je teplota mrazu čistej vody 0 ° C, teplota zamrznutia koncentrovaného vodného roztoku je nižšia ako táto hodnota.
Vyvýšenie
Podľa Raaultovho zákona je vyvýšenie bodu varu čistého rozpúšťadla priamo úmerné molarite roztoku, ktorý vzniká pridaním rozpustenej látky. Koncentrované roztoky majú preto vyšší bod varu ako voda.
Osmotický tlak
Existujú dva oddiely s rôznymi koncentráciami, oddelené membránou, ktorá umožňuje vodu prejsť, ale obmedzuje priechod častíc rozpustených častíc.
Voda bude prúdiť z roztoku, ktorý má nižšiu koncentráciu rozpustenej látky do roztoku, ktorý má väčšiu koncentráciu rozpustenej látky.
Tento čistý prietok vody zmizne, pretože voda nahromadená v priehradke s najvyššou koncentráciou vytvára hydrostatický tlak, ktorý je proti toku vody do tohto priestoru.
Môže vám slúžiť: difenylamínPrietok vody osmózou sa vo všeobecnosti vyskytuje smerom k koncentrovaným roztokom.
Rozdiely medzi koncentrovaným roztokom a zriedeným roztokom
-Koncentrované roztoky majú vysoký podiel rozpustenej látky vo vzťahu k objemu alebo hmotnosti roztoku. Zriedené roztoky majú nízky podiel rozpustenej látky vo vzťahu k objemu alebo hmotnosti roztoku.
-Majú molaritu, molealitu a normálnosť väčšiu ako riešenia prezentované zriedenými roztokmi.
-Mrazivé body koncentrovaných roztokov je nižší ako bod zriedených roztokov; to znamená, že zamrznú pri chladnejších teplotách.
-Koncentrovaný roztok má menší tlak pary ako zriedený roztok.
-Koncentrované roztoky majú vyšší bod varu ako ten, ktorý predstavuje zriedené roztoky.
-Kontakt cez semipermosabilnú membránu, voda bude prúdiť z zriedených roztokov do koncentrovaných roztokov.
Príklady riešení
Koncentrovaný
-Med je nasýtený cukor roztok. Je bežné pozorovať výskyt rekryštalizácie cukru, čo je dôkazom v tapas nádobách obsahujúcich med.
-Morská voda, ktorá má vysokú koncentráciu rôznych solí.
-Moč od ľudí s ťažkou dehydratáciou.
-Sýtená voda je nasýtený roztok oxidu uhličitého.
Zriedený
-Moč človeka s nadmerným prívodom vody.
-Pot je zvyčajne nízka osmolarita.
-Mnoho liekov dodávaných v roztoku má nízku koncentráciu.
Odkazy
- Wikipedia. Koncentrácia. Obnovené z: je.Wikipedia.orgán
- Fusta l. Koncentrácia riešení: Definícia a úrovne. Štúdium. Získané z: štúdie.com
- Vodné roztoky - molarita. Získané z: Chem.UCLA.Edu
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.

