Haloidné vlastnosti predaja, nomenklatúra, ako sa tvoria, príklady

- 3162
- 316
- Gabriel Bahna
Ten haloidové soli Sú to binárne zlúčeniny tvorené kovom a ne -metal, bez iného prvku. Tieto soli sú tvorené neutralizačnou reakciou medzi hydracovou kyselinou so bázou. Napríklad: Reakcia medzi kyselinou chlorovodíkovou (HCI) s hydroxidom sodným (NaOH) za vzniku chloridu sodného (NaCl).
Haloidné soli sa tiež tvoria reakciou hydracie s kovom. Napríklad: reakcia horčíka s kyselinou chlorovodíkovou za vzniku chloridu horečnatého (MGCL2). Ako je zrejmé, chloridy sú najreprezentatívnejšími haloidnými soľami. Nie sú však jediní.
 Halita, chlorid sodný v prírodnom stave, je hlavným príkladom haloidnej soli. Zdroj: http: // gl.Wikipedia.org/w/index.Php?Title = užívateľ: shinichi / verejná doména
Halita, chlorid sodný v prírodnom stave, je hlavným príkladom haloidnej soli. Zdroj: http: // gl.Wikipedia.org/w/index.Php?Title = užívateľ: shinichi / verejná doména Haloidné soli podľa niektorých definícií chápu zlúčeniny, ktoré obsahujú vo svojej halogénovej štruktúre; To znamená: fluór, chlór, bróm a jód, takže sa považujú.
Podobne sú do haloidných soli zahrnuté niektorými autormi, zlúčeniny tvorené spojením kovu s prvkom, ktorý používa jeho negatívnu valenciu, vrátane: karbidov, nitridov, fosfúrí, sulfidov, seleniurov, arzéniur atď. Tieto sa tiež počítajú ako haloidné soli, kedykoľvek sa skladajú z dvoch prvkov.
[TOC]
Haloidné vlastnosti predaja
Haloidové soli sú skupina zlúčenín, ktorých vlastnosti je ťažké vytvoriť.
Silné iónové odkazy
Všeobecne sa skladajú zo tuhých látok so silnými iónovými väzbami medzi iónmi dvoch prvkov: M+X-, kde m+ zodpovedá metalickým katiónom a x- anión odvodený z nemeta.
Vysoké teploty topenia, varenie a sublimácia
Zvyčajne majú veľmi vysokú fúziu, vriace a sublimačné body, presne kvôli sile jej kryštalickej štruktúry.
Môže vám slúžiť: DAPI (4 ', 6-diamidino-2-fenylindol): Charakteristiky, nadácia, použiteVedenie elektrickej energie
V pevnom stave sú zlé vodiče elektriny, ale vo vodnom roztoku, keď ionizujú alebo keď sa zlúčia, sa stanú dobrí vodiči.
Vzhľad
Sú to kryštalické tuhé látky, ktoré sa môžu stať fragmentovaným práškom biele sfarbenie. Mnoho haloidných solí však môže mať iné sfarbenie. Napríklad chlorid niklu je zelený, zatiaľ čo chlorid železitý má oscilujúce sfarbenie medzi zelenou a červenou farbou.
Rozpustnosť
Väčšina halurosových soli je rozpustná vo vode, s výnimkou striebro, olova (II) a Merkúr halogenidov (i).
Vôňa
Pretože to nie sú prchavé zlúčeniny, haloidné soli nepredstavujú silné zápach. Kvôli ich zloženiu môžu byť tiež kyslé, slané, horké alebo sladké príchute.
Menovanie
Haloidové soli sa pomenujú umiestnením názvu aniónu príponou aurochy, nasledované názvom kovu priamo, ktorému predchádza spojenie z. V prípade, že kov má viac ako jednu valenciu, kov je umiestnený s príponou medveď, V závislosti od jeho Valencie.
Názov kovu je možné umiestniť aj bez prípony a s počtom oxidácie v zátvorkách.
Napríklad: chlorid železa (III) alebo chlorid železitý, FECL3.
Ako sa tvoria haloidné soli?
Haloidové soli sa tvoria hlavne tromi reakciami: neutralizácia, kyslá reakcia s kovom a reakcia kovu s kovom alebo net -kov pôsobiacim s negatívnou valenciou.
Neutralizačná reakcia
Je to reakcia kyseliny so bázou, ktorá produkuje soľ a molekulu vody. Napríklad:
HCl +NaOH → NaCl +H2Ani
Tento príklad bol spomenutý pre princa.
Reakcia kyseliny s kovom
Silná kyselina môže reagovať s kovom, pôvodom soľou a uvoľňovaním vodíka (H2). Napríklad: kyselina chlorovodíková reaguje so zinkom (Zn) za vzniku chloridu zinku (ZnCl2):
Môže vám slúžiť: Analytická chémiaZn +HCl → ZnCl2 + H2
Kombinácia kovu s kovom alebo ne -metal
Tieto haloidné soli vyplývajú z kombinácie kovu s kovom alebo neovery z halogénov. Napríklad: hliníkový fosfuro kombinuje fosfor s Valencia -3, s hliníkom s Valencia +3. Teraz je táto „kombinácia“ spôsobená špecifickými výrobnými reakciami pre každú soľ.
Použitie/aplikácie
Kov halogenurózy
Halogenuros kovu sa používajú vo vysoko intenzívnych žiarovkách, ako sú moderné žiarovky. Používajú sa tiež v skleníkoch alebo v dažďových klimatických podmienkach na doplnenie prirodzeného svetla. Strieborné halogenidy sa používajú vo filmoch a fotografických papieroch.
Chlorid vápenatý
 Vzhľad chloridu vápenatého
Vzhľad chloridu vápenatého Chlorid vápenatý sa používa ako zdroj vápnika pri čistení odpadových vôd. Používa sa tiež ako zdroj vápnika prostredníctvom jej elektrolýzy. Používa sa pri liečbe srdcových arytmií av prípadoch závažnej hypokalciémie.
Chlorid železitého
Chlorid železitý sa používa pri čistení odpadových vôd a čistení vody. Používa sa tiež na zaznamenanie alebo zvolenie pre meď a zasiahnutie ako katalyzátor v procese syntézy vinylchloridu.
Chlorid a draselný bromid
Chlorid draselného sa používa ako hnojivo a pri liečbe hypokaliémie alebo hypokaliémie. Bromid draselného, na druhej strane, sa použil ako antikonvulzívny a v súčasnosti sa používa vo farmaceutickom priemysle a ako obliekanie.
Chlorid a sulfid sodný
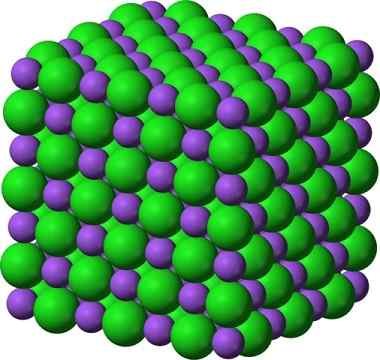
 Kryštalická štruktúra chloridu sodného, NaCl, typická iónová zlúčenina. __ fialové gule predstavujú katióny sodíka, Na +a __ zelené gule predstavujú chlorid anchov, cl -.
Kryštalická štruktúra chloridu sodného, NaCl, typická iónová zlúčenina. __ fialové gule predstavujú katióny sodíka, Na +a __ zelené gule predstavujú chlorid anchov, cl -. Chlorid sodný sa používa ako potravinová príchuť, pri zachovaní mäsa, ako antiseptikum, pri ťažkej hyponatrémii atď. Sulfid sodný sa používa v jadrových reaktoroch vo výrobe ťažkej vody, pri odstraňovaní chĺpkov kože a pri výrobe gumov, farbív a obrazov.
Môže vám slúžiť: oxid hliníka: štruktúra, vlastnosti, použitie, nomenklatúraFosfurí a dusičnany
Hliníkový fosfuro sa používa ako širokopásmový polovodič a ako insekticíd. Medzitým sa Gallium Nitruro používa ako polovodič.
Príklady haloidných solí
Okrem príkladov uvedených v predchádzajúcej časti, ďalšie haloidné soli s ich príslušnými vzorcami a menami:
-NaCl: chlorid sodný
-KCL: chlorid draselného
-Kacl2: Chlorid vápenatý
-Mgcl2: Chlorid horečnatý
-CSCL: chlorid cesium
-Bacl2: Chlorid bária
-Fecl2: Chlorid železia
-Fecl3: Chlorid železitý
-Nicl2: Niklová chlore
-CUCL: Cuprous chlorid
-Cucl2: Cupric chlorid
-AGCL: Chlorid strieborného
-Zncl2: Chlorid zinku
-Cdcl2: Chlorid kadmia
-Hgcl2: Merkurický chlorid
-Alcl3: Hliníkový chlorid
-NABR: Bromid sodný
-KBR: Bromid draselný
-CSBR: Cesium Bromid
-CDBR: Cadmium Bromid
-Mgbr2: Bromid horčíka
-Srbr2: Bromid strontium (II)
-Ki: draslík Yoduro
-NAI: jodid sodný
-CSI: Cesium Yoduro
-Ali3: Jodid hliníka
-HDP2: Olovo jodid (ii)
-NAF: fluorid sodný
-LIF: lítium fluorid
-Kaviareň2: Fluorid vápnika
-Ptf2: Platinový fluorid (II)
-Pod2: Sulfid sodný
-Li4C: lítiový karbid
-Mg2C: Karbid horčíka
-ALP: hliníkový fosfuro
-Jo3N4: Silicon Nitruro
-Tin: Titanium Nitruro
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Julián Pérez Porto a María Merino. (2016). Definícia haloidných soli. Definícia.z. Obnovené z: definície.z
- James P. Biť. (5. júna 2019). Halogenta. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Wikipedia. (2020). Halogent. Zdroj: In.Wikipedia.orgán
- « Vlastnosti peroxidov, nomenklatúra, použitia, príklady
- Charakteristiky termohigometrov, funkcie, časti, použitie »

