Vlastnosti peroxidov, nomenklatúra, použitia, príklady
- 4229
- 431
- JUDr. Rudolf Čapkovič
Ten peroxidy Všetky sú to tie chemické zlúčeniny, ktoré obsahujú skupinu peroxo, O-O, buď kovalentne spojené s atómami uhlíka alebo inými funkčnými skupinami alebo v iónovej forme, ako je peroxidový anión, alebo22-. Vyššie uvedené je graficky znázornené na obrázku nižšie. V ňom skupina O-O vyniká modrou farbou.
Môžu existovať organické peroxidy, ako sú diaquilperoxidy (r (r1-O-O-R2), Hydroperoxidy (R-O-O-H), peracidy (RCO-O-O-H) a Peéstres (R1Co-O-O-R2). Máme tiež anorganické peroxidy, ako sú peroxidy kovov (Mn+Ani22-) a peroxid vodíka (H-O-H). Ten je najznámejší zo všetkých a prijíma názov peroxidu vodíka.
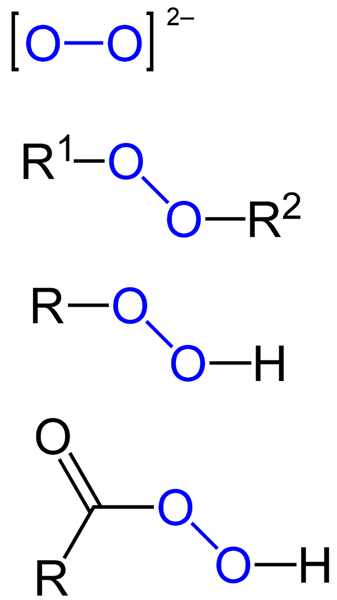 Vzorce pre rôzne typy peroxidov, ktoré existujú. Zdroj: Jü / verejná doména
Vzorce pre rôzne typy peroxidov, ktoré existujú. Zdroj: Jü / verejná doména Všetky peroxidy spoločne zdieľajú vlastnosť, že sú veľmi reaktívne, oxidačné látky a v niektorých prípadoch výbušniny. Pokiaľ ich syntetizáciou nie sú špecifikované, považujú sa za nežiaduce a nebezpečné nečistoty pre mnoho priemyselných procesov a pre laboratórnu syntézu.
Peroxidy sú vo všeobecnosti vynikajúce oxidačné činidlá, bielenie, baktericídy a aktivátory polymerizácií prostredníctvom tvorby voľných radikálov. Preto sú to zvyčajne veľmi užitočné činidlá alebo prísady v polymérnom priemysle, ako aj v potravinárskom priemysle na urýchlenie oxidácií a odstránenie baktérií.
[TOC]
Peroxidové vlastnosti
Štruktúra
Peroxidové štruktúry sa zameriavajú okolo skupiny O-O. Každý atóm kyslíka má hybridizáciu SP3, Takže odkazy -o -o ne odpočívajú v rovnakej rovine. Napríklad pre peroxid vodíka, H-O-H, uhol tvorený medzi dvoma h je 115.5., ktorý ukazuje, že štyri atómy nie sú v lietadle.
Deformácie tohto a ďalších uhlov budú závisieť od identity ostatných molekulárnych fragmentov spojených so skupinou O-O.
Môže vám slúžiť: Gibbs Free Energy: Jednotky, ako sa vypočítava, vyriešené cvičeniaNa druhej strane, organické a anorganické peroxidy (s výnimkou kovového) možno rozpoznať voľným okom, ak je skupina O-O podrobne opísaná v ich štruktúre, napríklad dve okuliare s „ústami“. Týmto spôsobom je akýkoľvek peroxid okamžite identifikovaný s jediným pohľadom na svoju štruktúru.
Reaktivita
O-O Link je relatívne slabý v porovnaní s inými odkazmi, ako sú C-H alebo C-O. Preto má tendenciu prelomiť alebo fragmentom produkovať vysoko reaktívne okysličené radikály.
Sú kvôli týmto radikálom, že peroxidy sú klasifikované ako reaktívne a nebezpečné látky, pretože môžu vo všeobecnosti poškodiť tkanivá a akékoľvek organické látky.
Oxidačná činnosť
Peroxidy sú silné oxidačné činidlá, ktoré sa snažia získať elektróny z prostredia na transformáciu na vodu, kyslík alebo hydroxidy. Napríklad peroxid vodíka je silnejším oxidačným činidlom ako ten istý permanganistan draselný.
Tento oxidačný účinok sa používa na ich detekciu ich reakcie s sulfátom železitým a tiokyanátom draselným:
Peroxid +viera2+ + SCN- → Fe (SCN)n(3-N)- (N = 1 až 6).
Komplex vytvorený medzi vierou3+ a SCN- Je krvná červená, takže pozorovanie tejto farby zodpovedá pozitívnemu testu na prítomnosť peroxidov vo vzorke.
Citlivosť
Peroxidy sú látky citlivé na vysoké teploty a slnečné svetlo. Preto musia byť uložené v bezpečných miestach a v plastových a nepriehľadných nádobách, aby ich svetlo priamo neovplyvnilo.
Menovanie
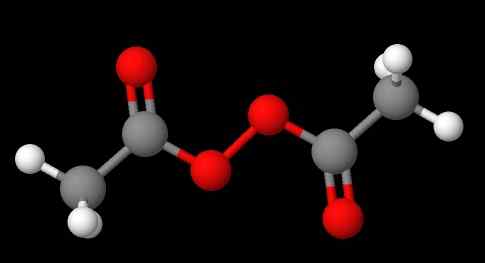
Nomenklatúra peroxidov závisí od toho, ktorý typ patria. Všeobecne platí, že mnohí sú menovaní zmienkou „peroxid“, po ktorom nasledujú substituenty r v abecednom poradí. Napríklad zlúčenina ch3C (o) ooc (o) ch3 (nižší obrázok) sa nazýva diacetyl alebo acetylperoxid, pretože má na každom konci acetylovú skupinu.
Môže vám slúžiť: síran sodný (NA2SO4): Štruktúra, vlastnosti, použitia, získanie Diacetyl peroxid. Zdroj: Gabriel Bolívar cez Molview.
Diacetyl peroxid. Zdroj: Gabriel Bolívar cez Molview. Zlúčenina C6H5C (o) ooc (o) c6H5 (nižší obrázok), na druhej strane sa nazýva Dibenzoílo alebo peroxid benzoílo, z tých istých dôvodov uvedených v predchádzajúcom odseku.
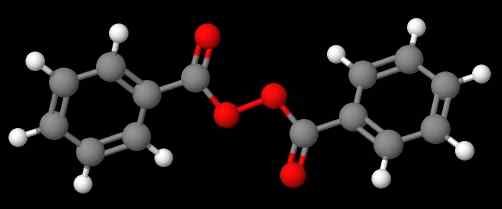 Benzoylperoxid. Zdroj: Gabriel Bolívar cez Molview.
Benzoylperoxid. Zdroj: Gabriel Bolívar cez Molview. Medzitým zlúčenina C6H5C (o) ooc (o) ch3 sa nazýva peroxid acetyl benzolelo. Tentoraz je acetyl substituent uvedený ako prvý na začatie písmena „a“. Ďalším príkladom je ch3Chvály2Ooc6H5, nazývaný etylfenylperoxid.
Podobne pokračujte s hydroperoxidmi. Napríklad Cho3OOH sa nazýva metyl hydroperoxid.
Výcvik
Niektoré peroxidy môžu byť vytvorené priamo expozíciou príslušnej látky s kyslíkom vzduchu, asistované alebo nie s kovovými katalyzátormi. Môžu sa tiež tvoriť vystavením látky ozónu za určitých podmienok, vykonávaním ozonolýznej reakcie.
Ďalšou syntetickou cestou je reagovať peroxid vodíka s alkyrsulfátom:
R2SW4 + H2Ani2 → R-O-R +H2SW4
Aby sa syntetizovali alebo vytvorili diachilické peroxidy alebo dokonca cyklické peroxidy.
Medzitým niekoľko metód na vytvorenie peroxidov kovov je založené na okyslizácii ich príslušných oxidov kovov, takže „kyslík“ a prechádzajú z MO (m (m (m (m (m (m (m (m (n+Ani2-) Láska2 (Mn+Ani22-).
Používa peroxidy
Iniciátory polymerizácie
Peroxidy, najmä organické peroxidy, sa pridávajú k reakčným prostriedkom na syntézu nekonečiek plastov a materiálov, ako je polystyrény, silikón, epoxid a akrylové živice, polyvinylchlorid, skloňové vlákna medzi ostatnými.
Je to preto, že trpia tepelnými rozkladmi, aby sa stali okysličenými voľnými radikálmi, ktoré následne spúšťajú a katalyzujú polymerizácie. Preto sú žiaduce v polymérnom priemysle.
Môže vám slúžiť: Molárna frakcia: Ako sa vypočítava, príklady, cvičeniaNiektoré z peroxidov používaných ako iniciátory sú peroxid metyl Cetona (MEK) a peroxid acetón.
Bieliace a dezinfekčné prostriedky
Peroxidy sú bieliace látky, ktoré sa používajú na bielenie papiera a buničina z múky. Sú to tiež dezinfekčné činidlá, úplne účinné, ale agresívne, pokiaľ ide o vyhladenie baktérií. Klasický príklad zodpovedá peroxidu vodíka, ktorý je určený v zriedených roztokoch (3%) na dezinfekciu rán.
Oxidačné činidlá
Peroxidy sú tiež oxidačné činidlá, takže nájdu veľa použití pri organickej syntéze veľmi okysličených látok.
Kyslíkové zdroje
Aj keď nie je jedným z hlavných použití, peroxidy môžu slúžiť aj ako zdroje kyslíka v niektorých svojich poruchách. To je opäť peroxid vodíka.
Príklady peroxidov
Nakoniec budú uvedené niektoré príklady peroxidov, či už organických alebo anorganických, s ich vzorcami a príslušnými názvami:
-H2Ani2: Vodík alebo peroxid vodíka
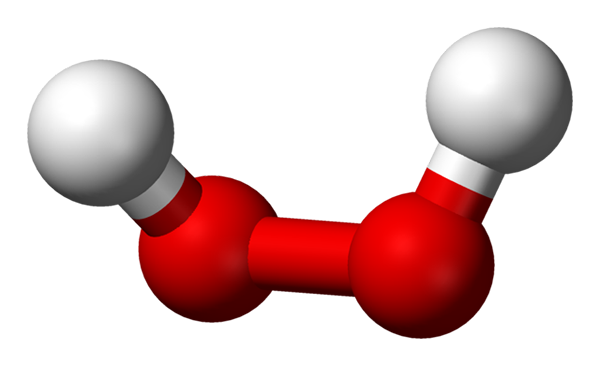 Molekula peroxidu vodíka predstavovaná s guľovými a stĺpcovými modelmi. Zdroj: Benjah-Bmm27 Via Wikipedia.
Molekula peroxidu vodíka predstavovaná s guľovými a stĺpcovými modelmi. Zdroj: Benjah-Bmm27 Via Wikipedia. -Nat2Ani2: peroxid sodný
-Lúč2: peroxid bária
-C6H5C (ch3)2OOH: cummeno hydroperoxid
-(NH4)2Siež2Ani8: Amónny persulfát
- Hrebeň3Slzo3H: Kyselina peroxidisulfurová
-(Ch3)3Cooc (ch3)3: Ditert-butylperoxid
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10th Vydanie.). Wiley Plus.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Organický peroxid. Zdroj: In.Wikipedia.orgán
- Elsevier B.Vložka. (2020). Peroxid. Vedecký. Zdroj: ScienceDirect.com
- Vývoj pokročilého chémie. (s.F.). Alkoholy, fenoly a ich odvodené:
- Peroxidy pravidlo C-218. Obnovené z: acdlabs.com
- Vol'nov I.Jo., Petrocelli a.W. (1966) Klasifikácia a nomenklatúra anorganických peroxidových zlúčenín. In: Petrocelli a.W. (Eds) peroxidy, superoxidy a ozonidy alkalických a alkalických kovov. Springer, Boston, MA.
- « Typický Baja California Sur pre mužov a ženy (popis)
- Haloidné vlastnosti predaja, nomenklatúra, ako sa tvoria, príklady »

