Pravidlo páky
- 3815
- 270
- JUDr. Rudolf Čapkovič
Čo je pravidlo páky?
Ten pravidlo páky Je to matematický postup, ktorý umožňuje vypočítať frakcie, percentá alebo množstvá fáz prítomných v rovnováhe v binárnom systéme. Nielenže je to matematické, ale tiež dosť grafické a asertívne, je veľmi užitočné pri výpočtoch fyzikálno -chemických a inžinierstva.
Toto pravidlo sa vzťahuje na fázové diagramy pre binárne systémy, bez ohľadu na typ systému samotného systému. To znamená, že fázy môžu byť pevné, rovnako ako v prípade zliatiny; alebo kvapalné a plynné, ako vidíme v systémoch v rovnováhe kvapaliny.
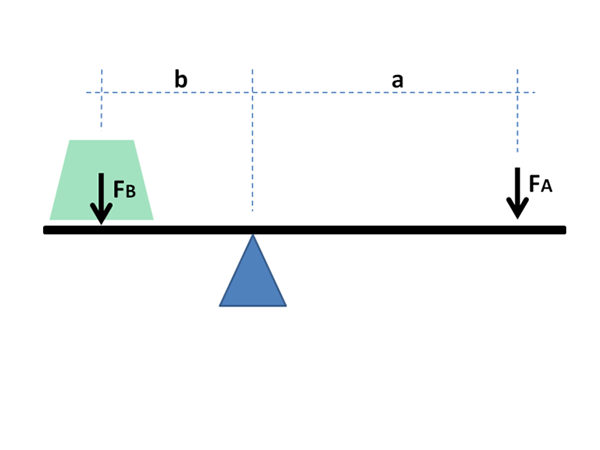
 Fyzikálny a matematický princíp páky sa používa aj na chemické účely a vo fyzike materiálov. Zdroj: Jimbowley, CC BY-SA 3.0, cez Wikimedia Commons
Fyzikálny a matematický princíp páky sa používa aj na chemické účely a vo fyzike materiálov. Zdroj: Jimbowley, CC BY-SA 3.0, cez Wikimedia Commons Pravidlo páky sa môže uplatniť priamo, berúc do úvahy hodnoty grafiky v osi Abscissa, kde globálne frakcie alebo percentuálne podiely najprchavejšej zložky zvyčajne idú v prípade kvapalín; alebo žiaruvzdorné, v prípade kovov v zliatinách.
Ako bude uvedené nižšie, jeho názov je spôsobený obrovskou podobnosťou, ktorú má s matematickými výrazmi, ktoré demonštrujú rovnováhu medzi dvoma masami umiestnenými na koncoch rockeru s Fulcro.
Army páky musia vyvážiť, aby vyvážili masy záťaže; V prípade fázových diagramov, frakcie a mólov fáz v rovnováhe materiálu.
Vysvetlenie
Grafické aspekty
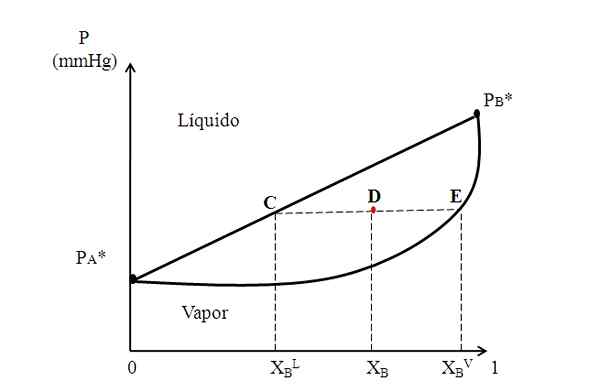 Hypotetický binárny diagram, kde väzobná čiara ukazuje zloženie kvapalných a parných fáz. Zdroj: Gabriel Bolívar.
Hypotetický binárny diagram, kde väzobná čiara ukazuje zloženie kvapalných a parných fáz. Zdroj: Gabriel Bolívar. V strede vyššie uvedeného diagramu máme oblasť, v ktorej koexistujú tekuté a pary; to znamená, že rovnovážna oblasť kvapaliny. Nad touto oblasťou bude zmes A a B tekutá a pod ňou bude sóda kvôli nižším tlakom.
Teraz zvážte zmes so zložením XB a ktorého tlak ho umiestni v bode D. Vytiahneme z bodu D horizontálna čiara, ktorá sa dotýka čiary a krivky po stranách, pôvodom bodov C a E, respektíve. Táto línia, ktorá oznamuje body C, D a E, C-D-E, je línia známa ako línia Únie a premietaním do osi a musí nám dať tlak systému.
Môže vám slúžiť: Vodná alkalita: Čo je, odhodlanie a významPotom z týchto bodov nakreslíme ďalšie čiary kolmé na väzobnú čiaru, ktorá bude hrať os x. Keď bod E spočíva na parnej krivke, potom budeme mať molárnu frakciu B vo fáze pary (xBVložka). Podobne nám bod C na priamke kvapaliny dá molárnu frakciu B v kvapalnej fáze (xBL).
Pravidlo páky je založené presne na väzbovej čiare a vzdialenosti medzi xBL, XB a xBVložka.
Matematický odpočet
Globálna molárna frakcia B sa rovná:
XB = nB / (nL + nVložka)
Kde nB Sú to celkové móly B vo fáze kvapaliny aj pary, a nL a nVložka sú príslušné móly pre tieto fázy. Vyčistenie nB budeme mať:
nB = XBnL + XBnVložka (1)
Na druhej strane, nB Tiež sa rovná:
nB = nBL + nBVložka
= XBLnL + XBVložkanVložka (2)
Teraz vyrovnanie rovníc (1) a (2) nám poskytne:
XBnL + XBnVložka = XBLnL + XBVložkanVložka
A usporiadať:
nL(XB - XBL) = nVložka(XBVložka - XB) (3)
nL(C-d) = nVložka(Z)
Tieto posledné dva matematické výrazy sú pravidlom páky. Všimnite si, že xB - XBL Je to vzdialenosť medzi bodmi C a D; a xBVložka - XB, Je to vzdialenosť medzi bodmi D-E: dve polovice väzbovej čiary (pákové ramená).
Táto rovnica je veľmi podobná rovnomernej rovnováhe mas na rockeri s Fulcro:
m1l1 = m2l2
Pravidlo páky nám teda umožní vypočítať celkové móly nL a nVložka za predpokladu, že sú známe celkové móly zmesi, nTón (nTón = nL + nVložka).
Druhá forma
Predchádzajúci výraz pre pravidlo páky slúži na výpočet množstiev (hmotnosti, móly atď.) fáz v rovnováhe. Najznámejšia verzia pravidla páky nám však umožňuje vypočítať frakcie alebo percentuálne podiely každej fázy, pričom medzi x berie iba vzdialenosti medzi xB, XBL a xBVložka.
Zoberme si rovnaký systém vyššie, ktorý máte inú formu pravidla páky:
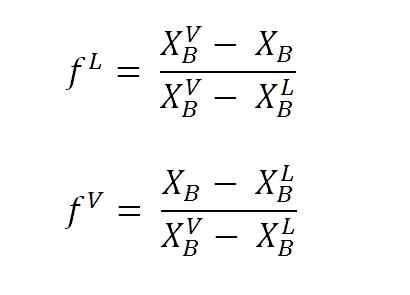 Rovnice na výpočet kvapalinových a parných frakcií pomocou páky ramien. Zdroj: Gabriel Bolívar.
Rovnice na výpočet kvapalinových a parných frakcií pomocou páky ramien. Zdroj: Gabriel Bolívar. Kde F L a F VložkaSú to molárne frakcie (alebo percento, v závislosti od grafu) fáz kvapaliny a pary. Všimnite si, že, samozrejme, F L a F Vložka Nemajú žiadne jednotky; zatiaľ čo nL a nVložka Áno, majú jednotky (móly, gramy atď.).
Môže vám slúžiť: reakčné teploPríklady
Spôsob 1
V nádobe 28 mólov B a 12 mólov A sú zmiešané. Stanovte množstvá a molárne frakcie pre vytvorené fázy.
Vypočítame xB:
XB = (28 molov B)/ (28 molov B + 12 molov A)
= 0.7
Táto hodnota zodpovedá xB horného diagramu. Odpočúvanie nám poskytne približne nasledujúce hodnoty pre xBL a xBVložka:
XBL = 0.41
XBVložka = 0.94
S pravidlom páky:
nL(XB - XBL) = nVložka(XBVložka - XB)
A vedieť to nTón = nL + nVložka, a? nTón = 40 mólov, potom vyčistíme nL ani nVložka v závislosti od druhého:
nL(XB - XBL) = (40 mólov - nL) (XBVložka - XB)
Usporiadanie a čistenie nL budeme mať:
nL = (40 mólov) (xBVložka - XB) / (XBVložka - XBL)
Nepamätá si tento výraz F L? Teraz nahradenie, budeme mať:
nL = (40 molov) (0.94 - 0.70) / (0.94 - 0.41)
= 18.11 mólov v kvapalnej fáze
Môžeme vypočítať nVložka Dvoma spôsobmi:
nVložka = nL(XB - XBL) / (XBVložka - XB)
ani
nVložka = 40 molov - 18.11 mólov
= 21.89 krtkov v parnej fáze
Metóda 2
Čo keď najskôr vypočítame F L a F Vložka?
F L = (XBVložka - XB) / (XBVložka - XBL)
= (0.94 - 0.70) / (0.94 - 0.41)
= 0.4528 alebo 45.28%
To znamená, 45.2% mólov je v kvapalnej fáze, čo je množstvo rovné:
nL = F LnTón
= (0.4528) (40 mólov)
= 18.11 mólov
A F Vložka Môžeme to vypočítať rovnako dvoma spôsobmi:
F Vložka = 1 - F L
ani
F Vložka = (XB - XBL) / (XBVložka - XBL)
Byť jej hodnotou:
F Vložka = 0.5472 alebo 54.72%
A preto, nVložka Bude to rovnaké:
nVložka = F VložkanTón
= (0.5472) (40 mólov)
= 21.89 mólov
Všimnite si, že použitie dvoch foriem pravidla páky ako metódy alternatívneho výpočtu je možné dosiahnuť rovnaké výsledky. Metóda 2 sa zdá byť priamejšia a jednodulnejšia; Ale ak sa pozorne pozoruje, po vyriešení zúčtovania nL ani nVložka, Zistí sa, že obe metódy sú v skutočnosti rovnako ľahké.
Vyriešené cvičenia
Ďalej sa vyriešia ďalšie dve cvičenia, kde sa zvážené systémy budú vyžadovať kvapalinové a nekrižadlové vapor. Schémy sú tiež grafické vzhľadom na teplotu systému a nie ich tlak.
Cvičenie 1
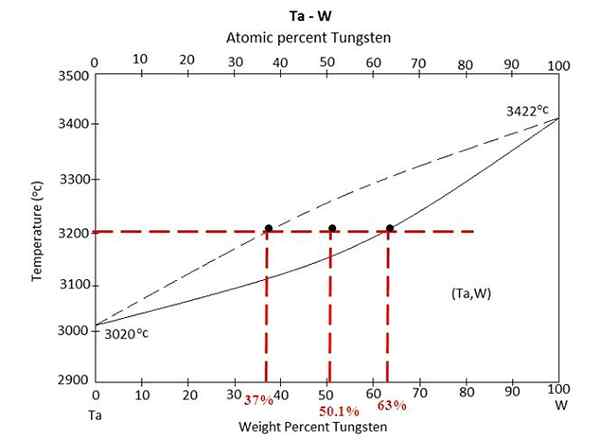 Fázový diagram pre zliatinu medzi Tantalo a volfrámom. Zdroj: Materialdia, CC BY-SA 4.0, cez Wikimedia Commons
Fázový diagram pre zliatinu medzi Tantalo a volfrámom. Zdroj: Materialdia, CC BY-SA 4.0, cez Wikimedia Commons Máme fázový diagram nad zliatinou medzi Tantalo a volfrámom, TA-W. Na osi x je znázornené globálne hmotnostné percentá volfrámu, W% (m/m).
V rámci kvapalinovej rovnovážnej oblasti (TA+W) a tuhej látky (zliatiny) je zmes pri 3200 ° C. Stanovte hmotnosti každej fázy za predpokladu, že sa zahrieva 100 gramov zliatiny.
Môže vám slúžiť: kovy, nemetály a metaloidyPostup
Tentoraz sa cvičenie vyrieši pomocou druhej formy pravidla páky. Linka Únie nám hovorí, že: V pevnej fáze máme 63% volfrámu, zatiaľ čo v kvapalnej fáze máme 37% volfrámu. Dôvodom je, že volfrám sa topí na vyššiu teplotu (3422 ° C) ako tantal (3020 ° C).
Takže máme:
W%Siež alebo wSiež= 63%
W%L alebo wL= 37%
A tiež:
W0 = 50.1%
Uplatňujeme pravidlo páky na F L:
F L = (63% - 50.1%) / (63% - 37%)
= 0.4961 alebo 49.61%
Všimnite si, že vzdialenosť zodpovedajúca kvapalnej fáze je rameno páky v blízkosti pevnej fázy, opačná strana stredného bodu.
Hmotnosť kvapalnej fázy je preto:
(0.4961) (100 gramov) = 49.61 roztavených gramov
A pevná fáza sa bude rovnať:
100 gramov - 49.61 gramov = 50.39 gramov zliatiny bohatých na volfrámu
Cvičenie 2
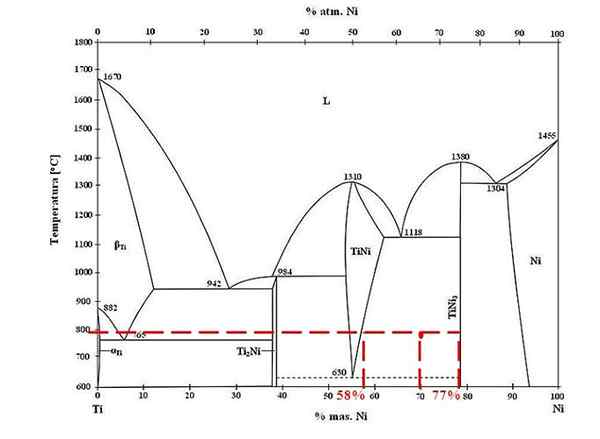 Fázový diagram pre zliatiny titánových a-a-zliatiny. Zdroj: Doomgiver, CC By-SA 3.0, cez Wikimedia Commons
Fázový diagram pre zliatiny titánových a-a-zliatiny. Zdroj: Doomgiver, CC By-SA 3.0, cez Wikimedia Commons Pre zliatinu titánu a niklu pri 800 ° C a so 70% niklu určte, koľko z Tini a Tini3 Sú prítomní.
Postup
Tentoraz žiadajú iba hromadné frakcie každej fázy. Červený bod je umiestnený v rovnovážnej oblasti medzi fázami TINI a TINI3, ktorých krivky sú tam, kde hrá líniu Únie, ktorá tečie k hodnotám 58% alebo pre fázu TINI a 77% alebo pre fázu TINI3.
Všimnite si, že červený bod je bližšie k fáze Tini3 fáza Tini. To znamená, že musí byť viac Tini3 že tini; A preto vzdialenosť alebo rameno páky zodpovedajúce TINI3 Musí to byť najdlhší, naopak (70%-58%).
Vedieť to, pokračujeme vo výpočte F Tini3:
F Tini3 = (70% - 58%) / (77% - 58%)
= 0.6316 alebo 63.16%
Naozaj, 63.16% zliatiny zodpovedá fáze Tini3. Medzitým fáza TINI zodpovedá:
1 = F Tini3 + F Tini
F Tini = 1 - F Tini3
= 0.3684 alebo 36.84%
Záverom z vzniku cvičení môžeme povedať, že pravidlo páky je veľmi užitočné na určenie frakcií každej fázy v rovnováhe pre systém dvoch komponentov.
Odkazy
- Walter J. Moore. (1963). Fyzikálna chémia. V chemickej kinetike. Štvrté vydanie, Longmans.
- Irán. Levine. (2009). Princípy fyzikálneho spôsobu. Šieste vydanie. MC Graw Hill.
- Wikipedia. (2020). Pravidlo páky. Zdroj: In.Wikipedia.orgán
- Michael Adewumi. (18. mája 2020). Pravidlo páky. Získané z: Eng.Librettexts.orgán
- Adam Warren. (1997). Fázové diagramy: kravaty a pravidlo páky. Získané z: Southampton.Ac.Uk
- University of Cambridge. (2020). Pravidlo páky. Zdroj: doitpoms.Ac.Uk

