Redukcia (chémia)
- 1909
- 93
- Blažej Hrmo
 Redukcia striebra. Zdroj: Gabriel Bolívar
Redukcia striebra. Zdroj: Gabriel Bolívar Aká je redukcia?
Ten zníženie Je to všetko, že chemická reakcia, kde atómy jedného z reagencií nakoniec získavajú elektróny, ktoré je možné vidieť aj týmto spôsobom: jeho voľné miesto alebo elektronické „nepohodlie“ sa zníži. Atom získava elektróny, keď ich druh daruje, to znamená, keď je oxidovaný.
Tento typ reakcie nemôže byť sám o sebe: ak druh akceptuje elektróny, musí im nevyhnutne dať ďalší. V opačnom prípade by sa hmota vytvorila z ničoho, čím by sa po získaní prázdnych elektrónov znížili atómy. Preto je to redoxné svetlo (redukcia/oxidácia).
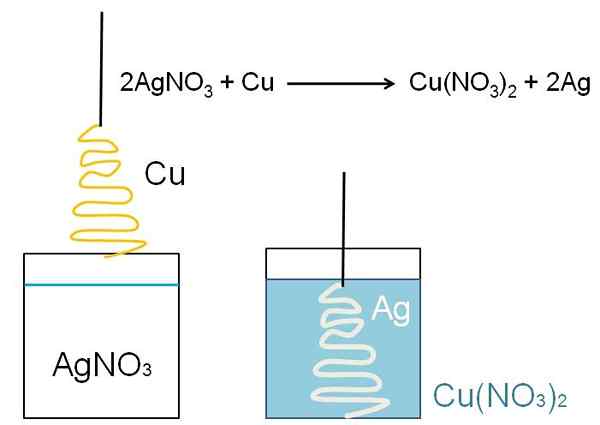
Ilustratívnym príkladom redukcie, ktorá sa môže zobrazovať v triedach, je reakcia medzi povrchom kovovej medi a vodným roztokom dusičnanu, Agno, Agno3.
V roztoku je striebro ako katióny AG+, pozitívne načítané. Tieto, pri interakcii s povrchom medi, vo forme vianočného stromu, elektróny sú odobraté z atómov meďnatého. Ak k tomu dôjde, meď nahradí striebro v dusičnanovej soli a v dôsledku toho sa tvorí dusičnan meďnatého, nie3)2.
Katión2+ Vedľa č3- Bluish roztok a strieborné stelesňuje vianočný stromček, akoby ho zakrývali snehom.
Aká je redukcia?
Pri redukcii už bolo povedané, že druh získava elektróny. Ako sa to dá skontrolovať v chemickej rovnici? Napríklad v reakčnej rovnici medzi Cu a Agno3, Ako zistiť, kedy dôjde k zníženiu? Na jeho overenie je potrebné určiť stav alebo oxidačný stav.
Môže vám slúžiť: elektronegativitaPrvky v ich prírodných stavoch majú ako definíciu stavu oxidácie rovnajúcej nule, pretože sa predpokladá, že nestratili alebo nevyhrali elektróny. Pevné kovy majú teda stav s nulovou oxidáciou. Striebro teda prechádza z +1 (AG+) A 0 (ag). Zaťaženie kovového iónu sa rovná jeho oxidačnému stavu.
Na druhej strane, elektróny pochádzajú z meďnatého: presunutie z 0 (Cu) na +2 (cu2+). Dusičnanový anión, nie3- zostáva nezmeniteľný, zatiaľ čo oba kovy vymieňajú elektróny. Preto je možné rovnicu napísať ako:
2Ag+ + Cu => 2ag + cu2+
Všimnite si, že zaťaženia aj atómy sú vyvážené.
Pozostáva z chemickej redukcie: pri zisku elektrónov, ktoré robia oxidačné stavy atómov, že elektróny zarábajú menej pozitívne.
Počet kyslíka
Kyslík je veľmi elektronegatívny a oxidačný atóm. Čím väčší počet kyslíka interagujúcich s atómom, tým pozitívnejšia bude jeho oxidácia. Alebo čo je rovnaké, je viac oxidované.
Preto, keď má zlúčenina menej atómov kyslíka, hovorí sa, že je menej oxidovaná. To znamená, že atóm stráca menej elektrónov.
Klasický príklad je možné vidieť pri oxidu a oxidu uhličitého. Pre CO má uhlík oxidačný stav +2, zatiaľ čo pre CO₂ je jeho oxidačný stav +4.
Takže, ak sa v reakcii CO₂ transformuje na CO, hovorí sa, že dochádza k zníženiu, pretože uhlík teraz interaguje s kyslíkom a nie dvoma. Pre opačnú reakciu, ko -transformovanie, hovorí sa o oxidácii uhlíka.
Môže vám slúžiť: chlorid železitý (FECL2): Štruktúra, použitie, vlastnostiPlatí to pre všetky atómy, najmä kovy v ich oxidoch kovu. Napríklad CRO2 (Cr4+) a cro3 (Cr6+).
V chemických rovniciach, kde druh stráca kyslík, zatiaľ čo druhý druh zarába, hovorí sa, že dochádza k prenosu kyslíka.
Elektronegatívny atóm
Vždy sa dá určiť, či došlo k zníženiu zmenou stavu oxidácie na menej kladnú hodnotu. Ako ste práve vysvetlili, rýchly spôsob, ako si to všimnúť bez toho, aby sa výpočty dodržiavali, pozoruje, či došlo k zníženiu atómov kyslíka v zlúčenine.
To isté sa môže stať s akýmkoľvek iným atómom, ktorý je viac elektronegatívny ako atóm, ktorý vyhrá alebo stráca elektróny.
Napríklad, ak CF4 reaguje takým spôsobom, že sa stáva cho4, Potom sa hovorí, že došlo k zníženiu, pretože fluorid je oveľa viac elektronegatívny ako atóm vodíka. Výsledkom je, že uhlík je v CHO menej oxidovaný4 že v CF4, čo je to isté, čo hovorí, že sa znížilo.
Príklady
Zníženie organickej chémie
Príklad CF4 a Ch4 Odráža to, čo sa deje pri organických reakciách, kde sa zníženie čiastočného zaťaženia atómu považuje za elektronický zisk. Pri zvažovaní redukcie okysličených funkčných skupín sa to značne uplatňuje.
Zvážte napríklad skupiny ROH, RCHO a COOH. Prvý zodpovedá alkoholom, kde je uhlík spojený s kyslíkom (C-OH); Druhou je skupina aldehydov, kde uhlíková tvorí dvojitú väzbu s kyslíkom a je tiež spojená s vodíkom (C = O-H) a tretím je karboxylová skupina.
Môže vám slúžiť: beryl hydroxid (be (oh) 2)V karboxylovej skupine tvorí uhlík dvojitá väzba s O a jednoduché spojenie s iným O (HO-C = O).
Preto dôjde k zníženiu, ak sa kyselina karboxylová transformuje na alkohol:
RcoOH => roh
Extrakcia kovu
Chemická redukcia je mimoriadne dôležitá v procesoch extrakcie kovov z ich minerálov. Niektoré reakcie sú:
HGS + O2 => Hg + So2
Sulfid ortuti sa redukuje na kovovú ortuť.
Cu2S + O2 => 2CU + SO2
Sulfid meďnatého na kovovú meď sa znižuje.
2ZN + 3o2 => 2zno + 2SO2
ZnO + C => Zn + Co (všimnite si prenos O).
Sulfid zinočnat.
Vernosť2Ani3 + 3CO => 2FE + 3CO2
Oxid železitý sa redukuje na kovové železo.
Hanba3 + 3h2 => W + 3h2Ani
A volfrámový oxid sa redukuje na kovový volfrám.
Ako cvičenie je možné oxidačné číslo kovu určiť pred znížením.
Ďalšie príklady
- Ión železa (iii) sa môže zredukovať na železo (II):
- Etino sa dá redukovať na eteno:
- Etanal sa môže zredukovať na etanol
Odkazy
- Oxidačné redukčné reakcie. Chémia obnovená.Librettexts.orgán.
- Definícia zníženia chémie. Zotavené z Thoughtco.com.




