Koncept, charakteristiky, príklady, cvičenia Bravais siete
- 3298
- 420
- MUDr. Žigmund Boška
Ten Siete Sú to sada štrnástich troch rozmerových jednotkových buniek, v ktorých atómy kryštálu. Tieto bunky pozostávajú z trojrozmerného usporiadania bodov, ktoré tvoria základnú štruktúru, ktorá sa pravidelne opakuje v troch priestorových smeroch.
Pôvod tejto nominálnej hodnoty pre základné kryštalické štruktúry pochádza z roku 1850, keď Auguste Bravais ukázal, že je možných iba 14 možných základných trojrozmerných jednotiek.
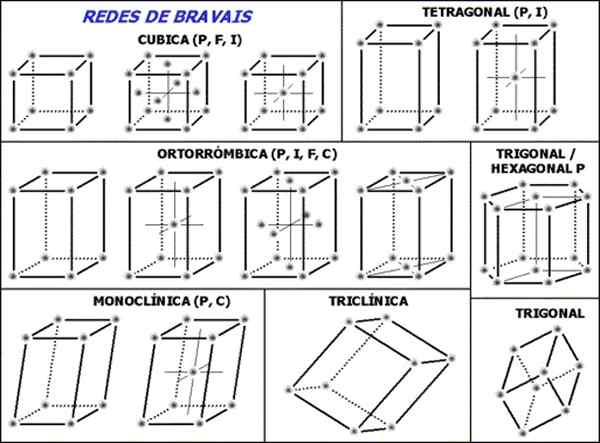
 postava 1. Siete Bravais sú sada 14 nevyhnutných a dostatočných jednotkových buniek na opis akejkoľvek kryštalickej štruktúry. (Wikimedia Commons)
postava 1. Siete Bravais sú sada 14 nevyhnutných a dostatočných jednotkových buniek na opis akejkoľvek kryštalickej štruktúry. (Wikimedia Commons) Sada 14 sietí Bravais je rozdelená do siedmich skupín alebo štruktúr podľa geometrie buniek, týchto sedem skupín je:
1- kubický
2- tetragonálny
3- ortorrombický
4- trigonal-hexagonálny
5- monoklinický
6- triklinický
7-trigonálny
Každá z týchto štruktúr definuje jednotnú bunku, ktorá je najmenšou časťou, ktorá si zachováva geometrické usporiadanie atómov v skle.
[TOC]
Charakteristiky sietí Bravais
Štrnásť sietí Bravais, ako je uvedené vyššie, sú rozdelené do siedmich skupín. Ale každá z týchto skupín má svoje jednotkové bunky s charakteristickými parametrami, ktoré sú:
1- Sieťový parameter (A, B, C)
2- počet atómov na bunku
3- Vzťah medzi sieťovými parametrami a atómovým rádiom
4-koordinačné číslo
5-balenie faktor
6- Intersticiálne priestory
7- Translaciami pozdĺž vektorov A, B, C sa kryštalická štruktúra opakuje.
Kubické siete
Skladá sa z jednoduchej alebo kubickej kubickej siete, kubickej siete zameranej na tváre alebo kubickú sieť F a kubickú sieť zameranú na kubické telo alebo sieť.
Všetky kubické siete majú tri tri Parametre siete zodpovedá adresám X, Y, z rovnakej hodnoty:
A = b = c
Kubická sieť P
Je vhodné zdôrazniť, že atómy sú reprezentované guľami, ktorých centrá sú vo vrcholoch kubickej bunky P.
Môže vám slúžiť: umelé satelityV prípade kubickej siete P počet atómov na bunku Je to 1, pretože v každom vrchole je iba ôsma časť atómu vo vnútri jednotkovej bunky, potom 8*⅛ = 1.
On Koordinačné číslo Označuje počet atómov, ktoré sú v blízkosti susedov v kryštalickej sieti. V prípade kubickej siete p je koordinačné číslo 6.
Kubická sieť i
V tomto type siete Okrem atómov vo vrcholoch kocky sa nachádza atóm v strede kocky. Tak číslo atómu na bunku Jednotný v kubickej sieti p je 2 atómy.
 Obrázok 2. Kubická sieť zameraná na telo.
Obrázok 2. Kubická sieť zameraná na telo. Kubická sieť f
Je to kubická sieť, ktorá má okrem atómov vo vrcholoch atóm v strede tváre každej kocky. On počet atómov na bunku Je to 4, pretože každý zo šiestich atómov tváre má polovicu vo vnútri bunky, hovorí 6*½ = 3 plus 8*⅛ = 1 vo vrcholoch.
 Obrázok 3. Kubická sieť zameraná na tváre.
Obrázok 3. Kubická sieť zameraná na tváre. Hexagonálna sieť
V tomto prípade je jednotková bunka priamy šesťuholníkový hranol. Hexagonálne siete majú tri tri Parametre siete zodpovedajúce splnenie nasledujúceho vzťahu:
A = b ≠ c
Je uhol medzi vektorom A a B 120 °, ako je znázornené na obrázku. Zatiaľ čo medzi vektormi A a C, ako aj medzi B a C sú priame uhly.
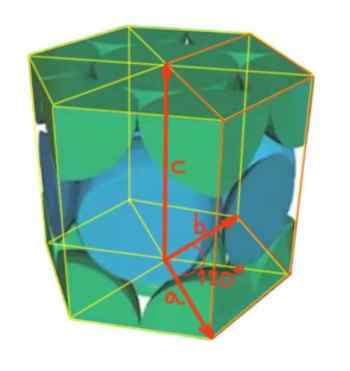 Obrázok 4. Hexagonálna sieť.
Obrázok 4. Hexagonálna sieť. On počet atómov na bunku Bude sa vypočítavať takto:
- V každej z 2 báz šesťuholníkového hranolu je v šiestich vrcholoch 6 atómov. Každý z týchto atómov zaberá ⅙ jednotnej bunky.
- V strede každej z 2 šesťuholníkových základov je 1 atóm, ktorý zaberá 1/2 jednotnej bunky.
- Na 6 bočných tvárach hexagonálneho hranolu sú 3 atómy, z ktorých každý zaberá ⅔ jednotkovej bunky a 3 atómy, ktoré zaberajú každý ⅓ objemu jednotkovej bunky.
Môže vám slúžiť: Počuť silu: povrchové a hmotnostné sily(6 x ⅙) x 2 + ½ x 2 + ⅔ x 3 + ⅓ x 3 = 6
Vzťah medzi parametrami siete A a B s atómovým polomerom R sa za predpokladu, že všetky atómy sú rovnakého rádu a sú v kontakte, je:
a/r = b/r = 2
Príklady
Kovy sú hlavnými príkladmi kryštalických štruktúr a tiež najjednoduchšie, pretože všeobecne pozostávajú z jedného typu atómu. Existujú však aj iné nemetalické zlúčeniny, ktoré tiež tvoria kryštalické štruktúry, ako je diamant, kremeň a mnoho ďalších.
- Železo
Železo má jednoduchú bunku kubickej jednotky s parametrom siete alebo okrajom A = 0,297 nm. V 1 mm existujú bunky 3,48 x 10^6 jednotiek.
- Meď
Má kubickú kryštalickú štruktúru sústredenú na tvári, tvorenú iba atómami medi.
- Drahokamy
Drahé drahokamy sú kryštalické štruktúry v podstate rovnaká zlúčenina, ale s malými časťami nečistôt, ktoré sú často zodpovedné za ich farbu.
diamant
Je zložený iba z uhlíka a neobsahuje nečistoty, a preto nemá farbu. Diamant má Kubická kryštalická štruktúra (izometrický hexoktahedrál) a je najťažším známym materiálom.
Štrbina
Skladá sa z oxidu oxidu kremičitého, zvyčajne je bezfarebný alebo biely. Jeho kryštalická štruktúra je trigonálna-Trapezoédrica.
Rubínový
Skladá sa z oxidu hlinitého s chrómovými nečistotami, ktoré mu dodávajú jeho charakteristickú červenú farbu. Tvorí jeden Hexagonálna kryštalická sieť.
Zafír
Je to tiež kryštál oxidu hliníka, ale s nečistotami titánu a železa, ktoré sú zodpovedné za svoju modrú farbu v rôznych odtieňoch. Ako Ruby má hexagonálna štruktúra.
Jadro
Drahý kameň všeobecne zelený, má Monoklinická štruktúra A je zložený z kremičitanu železa-magnézium-calcio.
Topaz
Je bezfarebný s a Ortorrombická štruktúra fluoridu hliníka hydroxidu.
Vyriešené cvičenia
Cvičenie 1
Nájdite vzťah medzi parametrom siete a atómovým polomerom pre kubickú sieť f.
Môže vám slúžiť: Teória veľkého tresku: Charakteristiky, fázy, dôkazy, problémy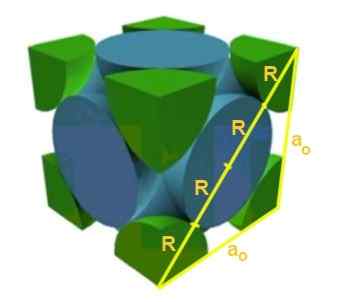
Riešenie: V prvom rade sa predpokladá, že atómy sú znázornené ako gule všetky polomer R v „kontakte“ medzi sebou, ako je znázornené na obrázku. Vytvára sa obdĺžnikový trojuholník, v ktorom sa splní:
(4 r)^2 = a^2 + a^2 = 2 a^2
Takže máte, že vzťah Edge-Radio je:
A/r = 4/√2
Cvičenie 2
Nájdite vzťah medzi parametrom siete a atómovým polomerom pre kubickú sieť I (zameraný na telo).
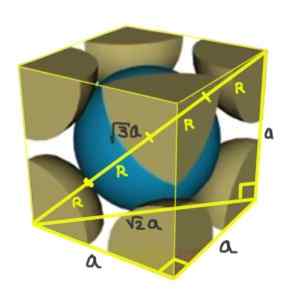
Riešenie: Atómy majú byť reprezentované ako všetky guľové gule v „kontakte“, ako je to znázornené na obrázku.
Dva obdĺžniky sú tvorené jedným z hypotenusa √2a a druhého z hypotenus √3a, ako sa dá preukázať pomocou Pythagorovej vety. Odtiaľ musíte vzťah medzi sieťovým parametrom a atómovým polomerom pre kubickú sieť I (sústredené v tele) je:
A/r = 4/√3
Cvičenie 3
Nájdite baliaci faktor F pre jednotkovú bunku kubickej štruktúry F (kubický sústredený na tváre), v ktorom majú atómy rádio R a sú v „kontakte“.
Riešenie: Baliaci faktor F je definovaný ako pomer medzi objemom obsadeným atómami v jednotkovej bunke a objemom bunky:
F = vatómy / Vbunka
Ako je uvedené vyššie, počet atómov na jednotku bunky kubickej siete zameranej na tváre je 4, takže balenie bude:
F = 4 [4πr^3/3] /[a^3] =…
… 4 [4πr^3/3]/[4R/√2]^3 = (√2) π/6 = 0,74
Odkazy
- Centrum akademických zdrojov krištáľových štruktúr. [PDF]. Získané 24. mája 2018, z: Web.iIT.Edu
- Kryštály. Získané 26. mája 2018, od: ThoughtCo.com
- Tlačové knihy. 10.6 latice štruktúry v kryštalických tuhých látkach. Získané 26. mája 2018, od: OpenTextBC.Ac
- Mdlák. (30. júna 2015). Typy kryštálových štruktúr. Získané 26. mája 2018, od: CrystalVisions-Film.com
- HelMestine, Anne Marie, PH.D. (31. januára 2018). Druhy
- Kittel Charles (2013) Solid State Physics, Condensed Matter Physics (8. vydanie). Mravný.
- Khi. (2007). Kryštalické štruktúry. Získané 26. mája 2018, od: Folk.Ntnu.Nie
- Wikipedia. Bravais latices. Zdroj: In.Wikipedia.com.
- « Konvexná definícia polygónu, prvky, vlastnosti, príklady
- Charakteristiky ľahkej energie, typy, získanie, príklady »

