Reverzibilné reakčné charakteristiky a príklady
- 3041
- 518
- MUDr. Žigmund Boška
A Reverzná reakcia Je to ten, ktorý v určitom okamihu v priebehu dosahuje stav rovnováhy, v ktorom zostávajú koncentrácie činidiel a produktov konštantné; to znamená, že sa nemenia, pretože rýchlosť, s akou sa konzumuje, je rovnaká, s ktorou sa druhý objaví. Hovorí sa tiež, že takýto stav zodpovedá dynamickej rovnováhe.
Rovnováha by sa však mohla považovať za dôsledok reverzibility chemickej reakcie; Pretože pri nezvratných reakciách nie je možné stanoviť akúkoľvek rovnováhu. Aby sa to stalo, výrobky musia byť schopné navzájom reagovať na seba, za špecifických podmienok tlaku a teploty, ktorá vznikne vrátená do reagencií.
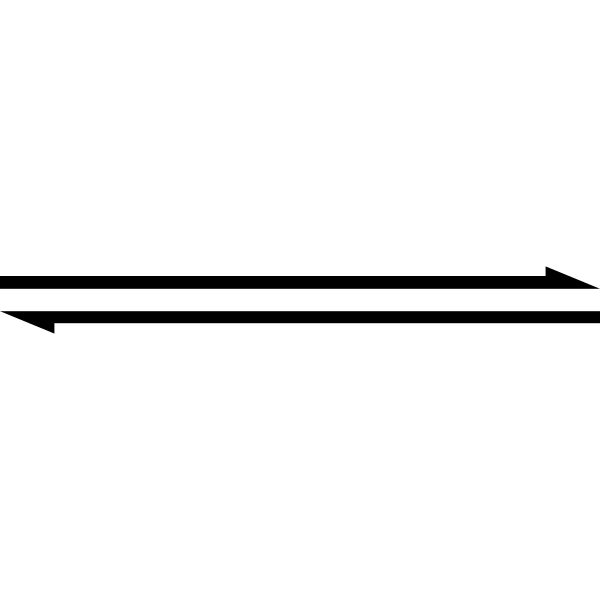
 Symbol s dvojitou šípkou naznačuje, že reakcia je reverzibilná. Zdroj: Tento obrázok SVG bol vytvorený médiom69.Cette image svg a é créée par perium69.Pripisujte prosím toto: William Crochot [verejná doména]
Symbol s dvojitou šípkou naznačuje, že reakcia je reverzibilná. Zdroj: Tento obrázok SVG bol vytvorený médiom69.Cette image svg a é créée par perium69.Pripisujte prosím toto: William Crochot [verejná doména] Vyššie uvedené je zjednodušené použitím symbolu dvojitého šípka (s dvoma antiparalelnými špičkami). Keď to vidíme v chemickej rovnici, znamená to, že reakcia pokračuje v oboch smeroch: zľava doprava (tvorba produktu) a sprava doľava (činidlo alebo reaktívna tvorba).
Menšina chemických reakcií je reverzibilná a nachádzajú sa viac ako všetky v organickej a anorganickej syntéze. V týchto.
[TOC]
Charakteristiky reverzibilných reakcií
Všeobecná rovnica a rovnováha
Reverzibilná reakcia má nasledujúcu všeobecnú rovnicu vzhľadom na to, že existujú iba dva reagenty, A a B:
A + B ⇌ C + D
Dvojitá šípka naznačuje, že A a B reagujú na produkciu C a D, ale aj C a D môžu navzájom reagovať, aby regenerovali regenery; to znamená, že reakcia v opačnom smere, sa koná sprava doľava.
Môže vám slúžiť: čo je Erristeneo?Priama reakcia pochádza z produktov, zatiaľ čo inverzné reagencie. Ak je niekto exotermický, druhý logikou musí byť endotermický a obe sa vyskytujú spontánne; Ale nie nevyhnutne rovnakou rýchlosťou.
Napríklad A a B môžu byť menšie alebo nestabilné ako C a D; A preto ich konzumujú rýchlejšie ako C a D ich môžu regenerovať.
Ak produkty C a D sotva navzájom reagujú, potom dôjde k väčšiemu akumulácii produktov ako činidiel. To znamená, že pri dosiahnutí chemickej rovnováhy budeme mať vyššie koncentrácie C a D ako z A alebo B, bez ohľadu na to, že sa ich koncentrácie nemenia.
Potom sa hovorí, že rovnováha je vysídlená doľava, kde bude viac produktov ako reagencií.
Princíp le -châtelier
Reverzibilná reakcia sa vyznačuje tým, že sa uskutoční v oboch smeroch v chemickej rovnici, dosahuje rovnovážny bod a reaguje na vonkajšie zmeny alebo vplyvy podľa princípu Le Châtelier.
V skutočnosti, vďaka tomuto princípu, Bertholletove pozorovania bolo možné vysvetliť v roku 1803, keď rozpoznal na kryštály na kryštály2Co3 V piesočnom jazere v Egypte. Reakcia dvojitého posunu by bola:
Nat2Co3(AC) + CACL2(Ac) ⇌ NaCl (ac) + Caco3(Ac)
Aby sa uskutočnila opačná reakcia, musí existovať prebytok NaCl, a preto by sa rovnováha posunula doprava: smerom k vytvoreniu NA2Co3.
Táto charakteristika má veľký význam, pretože tlaky alebo teploty sú tiež manipulované tak, aby uprednostňovali význam reakcie generovanej druhom záujmu.
Chemické zmeny
Chemické zmeny reverzibilných reakcií majú tendenciu byť menej zrejmé ako zmeny pozorované pre ireverzibilné reakcie. Existujú však reakcie, najmä tie, na ktorých sa zúčastňujú kovové komplexy, na ktorých vidíme zmeny sfarbenia závislé od teploty.
Môže vám slúžiť: Perrin Atomický model: Charakteristiky, postulátyChemický druh
Akýkoľvek typ zlúčeniny sa môže zapojiť do reverzibilnej reakcie. Bolo zrejmé, že dva soli sú schopné vytvoriť rovnováhu, na2Co3 a CACL2. To isté sa deje medzi kovovými komplexmi alebo molekulami. V skutočnosti je veľká časť reverzibilných reakcií spôsobená molekulami so špecifickými väzbami, ktoré sa znova a znovu a znovu regenerujú.
Príklady reverzibilných reakcií
Rozpustenie chloridu kobaltu
Roztok chloridu kobaltu, COCL2, Vo vode zafarbí ružovú, kvôli tvorbe komplexného ACU. Keď sa tento roztok zahrieva, farba sa zmení na modrú, čo dáva ďalšiu reverzibilnú reakciu:
[CO (H2Buď)6]2+(ac) (ružová) + 4cl-(AC) + Q ⇌ COCL42-(ac) (modrá) + 6h2Alebo (l)
Kde je dodávané teplo. Toto teplo dehydratuje komplex, ale keď sa roztok ochladí, alebo ak sa pridá voda, vráti sa do pôvodnej ružovej farby.
Vodíkový jodid
Nasledujúca reverzibilná reakcia je pravdepodobne najtradičnejšou pri zavádzaní koncepcie chemickej rovnováhy:
H2g) + i2(s) ⇌ 2HI (g)
Všimnite si, že reakcia dokáže vytvoriť rovnováhu, aj keď je jód v tuhom stave. Všetky druhy sú molekulárne: H-H, I-I a H-I.
Hydrolýza
Hydrolýza sú veľmi reprezentatívnymi príkladmi reverzibilných reakcií. Medzi najjednoduchšími máme toho, čo trpí konjugovanou kyselinou alebo bázou. Hydrolýza iónu amónneho, NH4+, a z uhličitanových iónov, co32-, sú nasledujúce:
NH4+(Ac) + h2Alebo (l) ⇌ nh3(g) + Oh-
Co32-(Ac) + h2Alebo (l) ⇌ hCO3-(Ac) + OH-
Ak pridáme základňu, ktorá poskytuje ióny OH- Uprostred vytlačíme obidve zostatky doľava.
Môže vám slúžiť: gadolinio: štruktúra, vlastnosti, získanie, použitieRozpustenie chromátu-Domato
Veľmi podobné ako v prvom príklade, roztok chromátu prechádza zmenou farby, ale v dôsledku variácií teploty, ale pH. Reverzibilná reakcia je:
2cro42-(ac) (žltá) + 2h3Ani+(Ac) ⇌ cr2Ani72-(Ac) (oranžová) + 3H2Alebo (l)
Takže, ak žlté rozpustenie CRO42- Je okyslený akýmkoľvek kyselinou, jej farba sa okamžite stane oranžovou farbou. A ak je pridané zásadité alebo veľké množstvo vody, rovnováha sa posunie doprava, znovu sa objaví žltá farba a konzumuje CR2Ani72-.
Amoniak
Syntéza amoniaku, NH3, Zahŕňa reverzibilnú reakciu, takže plynný dusík, veľmi inertný druh, reaguje:
N2g) + 3H2(s) ⇌ 2nh3g)
Esterifikácia
A nakoniec je uvedený príklad organickej chémie: Esterifikácia. To spočíva v získaní esteru z kyseliny karboxylovej a alkoholu v silnom kyslom médiu. Reverzibilná reakcia je:
RCOOH + R'OH ⇌ RCOOR ' + H2Ani
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Walter J. Moore. (1963). Fyzikálna chémia. V chemickej kinetike. Štvrté vydanie, Longmans.
- Irán. Levine. (2009). Princípy fyzikálneho spôsobu. Šieste vydanie, strana 479-540. MC Graw Hill.
- Wikipedia. (2020). Reverzná reakcia. Zdroj: In.Wikipedia.orgán
- HelMestine, Anne Marie, PH.D. (19. augusta 2019). Definícia a skúšky reverzibilnej reakcie. Zotavené z: Thoughtco.com
- Binod shrestha. (5. júna 2019). Reverzibilné a nezvratné reakcie. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- David Wood. (2020). Reverzibilné chemické reakcie: Definícia a skúšky. Štúdium. Získané z: štúdie.com
- « Polo rozvinutý vzorec Čo je a príklady (metán, propán, bután ...)
- Nezvratné reakčné charakteristiky a príklady »

