Typy reakcií syntézy, faktory, príklady
- 1194
- 269
- JUDr. Rudolf Čapkovič
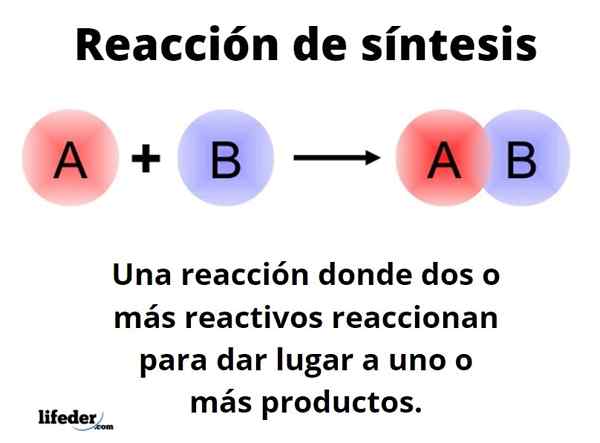
Ten Reakcia syntézy Je to jeden, v ktorom dva alebo viac reagencií reagujú na to, aby boli schopní kvantitatívne vzniknúť, jeden alebo viac výrobkov, či už na laboratórnej alebo priemyselnej úrovni. Toto je jedna z najzákladnejších reakcií chémie a jej typy a dizajny hraničia takmer nekonečno.
Generický spôsob môže byť reprezentovaný s formulárom: A+B → C. Pri jednoduchej syntéznej reakcii činidlo reaguje s iným činidlom B na výrobu produktu C. Hovorí sa, že pozostáva z jediného kroku. Môže sa však stať, že najprv reagovať s E, nasledovaným F a nakoniec s G (ďalšie činidlá), aby sa transformovala na produkt C; to znamená, že rovnaká reakcia sa uskutočňuje vo viacerých krokoch.

Bez ohľadu na jeden krok alebo mnoho krokov sú všetky syntézne reakcie založené na účinnosti (termodynamika a kinetika), s ktorou reagujú reaguje na transformáciu na produkty, ako aj experimentálny výkon. Je potrebné, aby syntetická reakcia úspešne prešla a vyrába čo najviac produktov.
[TOC]
Typy syntéznych reakcií
Jednoduché alebo viac
Syntézne reakcie nie je úplne ľahké klasifikovať. Môže to byť problém súvisiaci s kritériami chemika. Pretože? Predpokladajme, že viacnásobná reakcia je uvedená vyššie:
A + E → P1
P1 + F → P2
P2 + G → C
Byť p1 A p2 sprostredkovatelia, ktorí nie sú zaujímaví. Reakcia syntézy produktu alebo zlúčeniny C, začínajúca od hlavného činidla (obmedzujúce alebo obmedzujúce činidlo), je viacnásobná alebo komplexná, pretože sa vyskytuje v niekoľkých krokoch, na ktorých sa zúčastňujú ostatné činidlá: E, F a G.
Každá z predchádzajúcich troch reakcií môže pozostávať a sám o sebe typ chemickej reakcie. To znamená, že syntetická reakcia môže byť akéhokoľvek iného typu chemických reakcií (dvojité vytesnenie, redox, spaľovanie, neutralizácia, nitrácia, substitúcia atď.), pokiaľ produkt pochádza a má spojený experimentálny výkon.
Tak:
A + E → P1
Je možné to vnímať ako jednoduchú syntetickú reakciu pre produkt P1, bez ohľadu na typ reakcie, ktorá je. A tiež:
P1 + F → P2
Je to ďalšia jednoduchá syntetická reakcia pre produkt P2.
Anorganický alebo organický
Reakcie syntézy môžu byť akéhokoľvek druhu, pokiaľ ide o povahu reakcie a jej molekulárny mechanizmus. Tieto sa však dajú rozdeliť podľa chemickej povahy činidiel a výrobkov.
Môže vám slúžiť: octanu sodný: štruktúra, vlastnosti, syntéza, použitieNapríklad, ak reagencie sú anorganické látky, potom hovoríme o anorganickej syntéze; Zatiaľ čo keby to boli organické látky, už by sme hovorili o organickej syntéze.
Pole organickej syntézy je kolosálne, pretože pokrýva produkciu liekov, farbív, plastov, insekticídov, lepidiel, parfumov, konzervačných látok, medzi tisíckami ďalších výrobkov.
Faktory zapojené do syntéznych reakcií
Faktory zapojené do syntéznych reakcií sú všetky tieto parametre alebo premenné, fyzikálne a chemické. Niektoré z nich sú nasledujúce:
Teplota
Teplota je nevyhnutná pri akejkoľvek syntéznej reakcii. V závislosti od vašej termodynamiky môže byť vhodné, aby zostal nízky alebo vysoký. Podobne existujú rozsahy teplôt, v ktorých sú pravdepodobné bočné reakcie, takže je nevyhnutné ich ovládať a vždy ich overiť.
Čas
Čas je tiež nevyhnutný v reakciách na syntézu, pretože musí zabezpečiť, aby stačilo na zaručenie vytvorenia rovnováhy. Po určitom čase prestane viac produktu získať, a to vtedy, keď sa rozhodne úplne zastaviť syntézu.
Koncentrácie a kvalita činidiel
Čím sú reagencie koncentrovanejšie, tým rýchlejšie budú reakcie. Je však tiež nevyhnutné, aby sme si objasnili podiel jej koncentrácií, ako aj o jeho veľkosti, pretože minimálna zmena ovplyvní konečný výkon.
Na druhej strane, reagencie musia byť čo najčistejšie, inak sa predpokladajú chybné koncentrácie; Alebo horšie je, že výrobky budú kontaminované alebo dôjde k nežiaducim reakciám.
Agitácia
Spôsob, akým sa mieša reakčné médium, ovplyvní rapidy syntéznych reakcií.
Tlak
Tlak, podobne ako koncentrácia, hrá rozhodujúcu úlohu, najmä ak činidlá sú druhy sódy alebo látky. Čím väčší tlak, tým väčšie sú zrážky alebo interakcie medzi činidlami, a preto bude pravdepodobnejšie, že budú reagovať.
pH
PH (kyslá alebo základná) priamo ovplyvňuje mechanizmus reakcie, takže je kľúčovým faktorom pri definovaní toho, ktoré produkty sa získajú na konci syntézy.
Môže vám slúžiť: bod varu: koncept, výpočet a príkladyKatalyzátory
Katalyzátory sú látky, ktoré urýchľujú chemické reakcie, ale bez konzumácie počas procesu. Existuje syntéza, že bez vášho zásahu by to nebolo možné.
Príklady syntéznych reakcií
Ďalej a nakoniec sa citujú chemické rovnice na syntézu reakcií niekoľkých zlúčenín.
Stolová soľ (chlorid sodný)
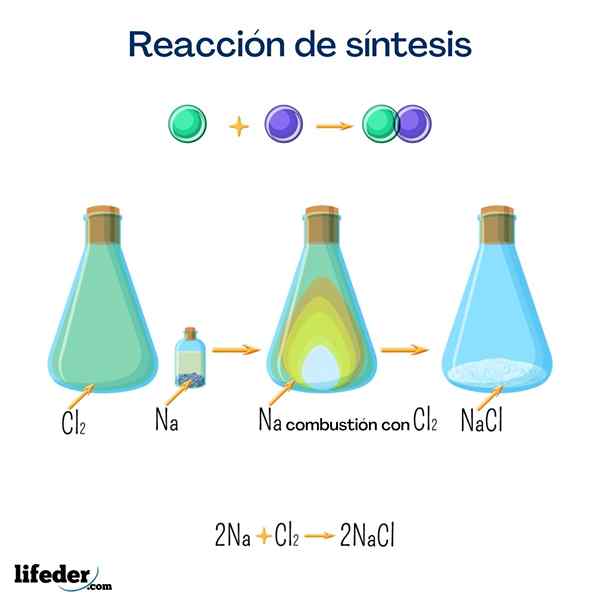
Táto soľ je jednou z najznámejších pre svoje veľké domáce použitie. Získa sa z sodíka a chlóru, a hoci ho dá získať nasledujúcou reakciou, je veľmi ľahké ho nájsť prirodzene.
2 Na+Cl 2 → 2 NaClGlukóza
Toto je jedna z najdôležitejších reakcií pre život, ako ho poznáme. Rastliny používajú oxid uhličitý a prostredie životného prostredia so slnečným žiarením na výrobu glukózy a kyslíka.
Reakcia veľmi všeobecným spôsobom je možné vidieť nižšie, ale je dôležité pochopiť, že za ním existuje niekoľko reakcií a mechanizmov, aby to bolo možné.
6CO2 + 6H2O → C6H12O6 + O2
Sacharóza
Táto syntéza sa vyskytuje v živých organizmoch a podáva sa pri polymerizácii glukózy s fruktózou. Vďaka svojej štruktúre tieto dve molekuly interagujú a konečným výsledkom je sacharóza a voda, ako je vidieť v nasledujúcej rovnici:
C6H12O6 + C6H12O6 → C12H22O11 + H2O
Amoniak
3 h2g) + n2g) → 2 NH3g)
Reagenty H2 a n2 Sú plynné. Tlak musí byť vysoký, aby vaše molekuly reagovali a vznikli amoniaku, NH3. Toto je jedna z najdôležitejších syntéznych reakcií priemyselnej chémie.
Vodná voda
2 h2g) + alebo2g) → 2 h2O (g)
H2 I2 Reagujte exotermicky na výrobu vodnej pary. Množstvo uvoľnenej energie je také, že vodík je jedným z najsľubnejších palív v leteckých aplikáciách.
Alkohol
C2H4g) + h2Alebo (l) → Cho3Chvály2Oh (l)
Etanol je známy ako alkohol, len je iba jedným z mnohých alkoholov, ktoré existujú. Jeho syntéza reakcie spočíva v hydratácii etylénu, c2H4 alebo h2C = ch2, kde sa k jeho dvojitej väzbe pridá molekula vody.
Kyselina sírová
Kyselina sírová má niekoľko účinných syntetických trás. Najjednoduchšie však pozostáva z niekoľkých krokov:
Môže vám slúžiť: karboxymetylcelulózaS (s) +o2g) → SO2g)
2 SO2g)+alebo2g) ⇌ 2 SO3g)
SW3g)+h2Alebo (l) → h2SW4g)
H2SW4g) → H2SW4(L)
Síra horí s nadbytkom kyslíka, aby sa najprv transformovala do SO2, A potom v tak3. Potom tak3 je hydratovaný na výrobu H výparov2SW4, ktoré nakoniec kondenzujú v h2SW4 tekutý. Táto syntéza je taká dôležitá, že sama osebe naznačuje, aké silné.
Metanol
CO (g) + 2 h2g) → ch3Oh (l)
Plyny Co a H2 reagovať a kondenzovať na kovové katalyzátory, aby sa vznikol metanolu, najjednoduchší alkohol zo všetkých.
Síran horečnatého
Môže sa vyskytnúť z veľmi jednoduchej reakcie, ktorá pozostáva z horčíka a kyseliny sírovej. Je veľmi ťažké nájsť ho v prírode bez vody.
Mg + H2SO4 → H2 + MgSO4
Oxid uhličitý
Stáva sa to prirodzene v niekoľkých procesoch, keď sa oxid uhličitý vyrába s molekulami oxidu uhličitého.
Je prítomný v prírodných procesoch, ako je dýchanie, ako činidlo vo fotosyntéze a vyskytuje sa ľahko v spaľovacích reakciách.
C +O2 → CO2
Kyselina chlorovodíková
Kyselina chlorovodíková sa široko používa ako lacná kyselina a ako reaktívne činidlo na syntézu iných zlúčenín.
CL2+H2 → 2HCL
Uhličitan vápenatý
Je všeobecne známy ako veľmi hojný agent v prírode, hlavne v skalách, mineráloch a škrupinách v mori. Jeho reakcia je založená na interakcii oxidu vápenatého s oxidom uhličitým.
CAO +CO2 → CACO3
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10th Vydanie.). Wiley Plus.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Morrison a Boyd. (1987). Organická chémia. (Piate vydanie). Addison-Wesley Iberoamericana.
- Metler Toledo. (s.F.). Reakcie na syntézu. Získané z: mt.com
- HelMestine, Anne Marie, PH.D. (27. augusta 2020). Popis reakcie syntézy plus skúšky. Zdroj z Thoughtco.com
- Wikipedia. (2020). Chemická syntéza. Zdroj: In.Wikipedia.orgán
- Danielle Reid. (2020). Syntéza reakcie: Definícia, vzorec a príklad. Štúdium. Získané z: štúdie.com

