Atómové rádio
- 3451
- 1020
- Tomáš Mydlo
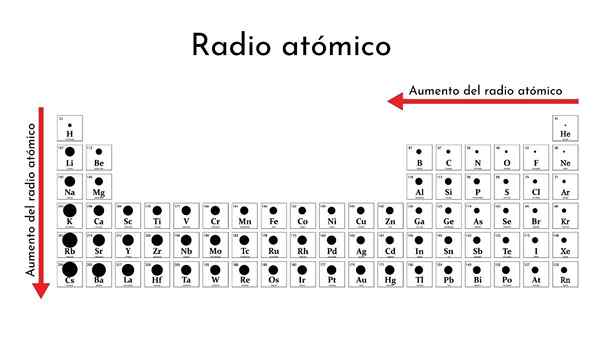
 Periodická tabuľka prvkov s atómovými rádiami
Periodická tabuľka prvkov s atómovými rádiami Čo je to atómové rádio?
On atómové rádio Je to dôležitý parameter pre periodické vlastnosti prvkov periodickej tabuľky. Priamo súvisí s veľkosťou atómov, pretože väčšie rádio, väčšie alebo objemné sú. Podobne to súvisí s elektronickými charakteristikami.
Zatiaľ čo atóm má viac elektrónov, tým väčšia je jeho atómová veľkosť a rádio. Obidve sú definované elektrónmi vrstvy Valencie, pretože na vzdialenosti za ich dráhami sa pravdepodobnosť nájdenia elektrónu blíži k nule. Opak sa vyskytuje v blízkosti jadra: Pravdepodobnosť nájdenia elektrónu sa zvýši.
 Bavlnená guľa. Spôsob, akým sú zhutnené, definuje svoju veľkosť a rádiá rovnakým spôsobom, ako sa stáva pri atómoch
Bavlnená guľa. Spôsob, akým sú zhutnené, definuje svoju veľkosť a rádiá rovnakým spôsobom, ako sa stáva pri atómoch Horný obrázok predstavuje balenie bavlnených guľôčok. Všimnite si, že každý z nich je obklopený šiestimi susedmi, nepočítajúc iný možný alebo dolný riadok. Spôsob, akým sú zhutnené bavlnené gule, definuje ich veľkosti, a preto ich rádiá; Rovnako ako pri atómoch.
Prvky podľa ich chemickej povahy interagujú s vlastnými atómami tak či onak. Preto sa veľkosť atómového polomeru líši podľa typu prítomného väzby a s pevným balením jeho atómov.
Ako sa meria atómový polomer?
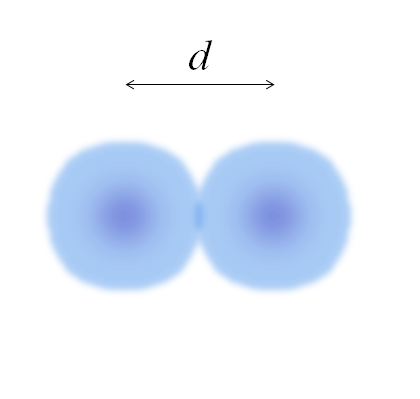 Obrázok dvoch atómov, ktorých hrany nie sú úplne definované. Zdroj: Gabriel Bolívar
Obrázok dvoch atómov, ktorých hrany nie sú úplne definované. Zdroj: Gabriel Bolívar Na predchádzajúcom obrázku to môže byť jednoduché. Guľa atómu však nie je úplne definovaná. Pretože? Pretože elektróny cirkulujú a rozmazajú sa v betónových oblastiach vesmíru: orbitály.
Preto sa atóm môže považovať za gule s nepodávajúcimi hranami, čo nie je možné s istotou povedať, kde končí. Napríklad v vynikajúcom obraze vyzerá oblasť stredu blízko jadra intenzívnejšou farbou, zatiaľ čo jej okraje sú rozmazané.
Môže vám slúžiť: SolvatáciaObrázok predstavuje diatomicku molekulu a2 (Ako CL2, H2, Ani2, atď.). Za predpokladu, že atómy sú sférické telá, ak bola určená vzdialenosť d To oddeľuje obe jadrá v kovalentnom spojení, potom by stačilo na to, aby sa rozdelilo na dve polovice (d/2) na získanie atómového polomeru; presnejšie, kovalentný polomer E pre e2.
Čo keby e nevytvoril so sebou kovalentné putá, ale bol to kovový prvok? Tak d Bolo by to naznačené počtom susedov obklopujúcich E v ich kovovej štruktúre; to znamená podľa koordinačného čísla (n.C) atómu vo vnútri obalu (nezabudnite na bavlnené gule obrázka).
Stanovenie internukleárnej vzdialenosti
Na určenie d, čo je internukleárna vzdialenosť pre dva atómy v molekule alebo balení, sú potrebné techniky fyzickej analýzy.
Jedným z najpoužívanejších je X -Bay Difrakcia. Vyžaruje lúč svetla cez sklo a študuje sa difrakčný vzorec vyplývajúci z interakcií medzi elektrónmi a elektromagnetickým žiarením.
V závislosti od obalu je možné získať rôzne difrakčné vzorce, a teda aj iné hodnoty d.
Ak sú atómy „tesné“ v kryštalickej sieti, budú predstavovať rôzne hodnoty d v porovnaní s tými, ktorí by mali, keby boli „pohodlní“.
Podobne sa tieto internukleárne vzdialenosti môžu pohybovať od hodnôt, takže atómový polomer v skutočnosti pozostáva z priemernej hodnoty takýchto meraní.
Ako súvisí s atómovým polomerom a koordinačným číslom? Vložka. Goldschmidt nadviazal vzťah medzi nimi, v ktorom pre n.C z 12, relatívna hodnota je 1; z 0.97 pre balenie, kde má atóm n.C rovnajúce sa 8; z 0.96, pre n.C rovnajúce sa 6; a 0.88 pre n.C zo 4.
Môže vám slúžiť: sodík permanganát (NamNO4): Vlastnosti, rizikáJednotky
Z hodnôt pre n.C rovnajúce sa 12, bolo postavených veľa tabuliek, kde sa porovnávajú atómové rádiá všetkých prvkov periodickej tabuľky.
Pretože nie všetky prvky tvoria takéto kompaktné štruktúry (n.C menej ako 12), používa sa pomer V. Goldschmidt na výpočet svojich atómových rádií a ich vyjadrenie pre rovnaké balenie. Týmto spôsobom sú merania atómových rádií štandardizované.
Ale v ktorých jednotkách sú vyjadrené? Vzhľad d Má veľmi malú veľkosť, jednotky Angstrom Å (10 ∙ 10-10m) alebo tiež široko používaný, pikomometer (10 ∙ 10-12m).
Ako sa zmeníte v periodickej tabuľke?
Za obdobie
Atómové rádiá určené pre kovové prvky sa nazývajú kovové rádiá, zatiaľ čo pre tie nemetalické prvky, kovalentné rádiá (napríklad fosfor, p4, alebo síra, s8). Avšak medzi oboma typmi rádií existuje výraznejšie rozlíšenie ako názov.
Zľava doprava v rovnakom období jadro pridáva protóny a elektróny, ale tieto sú obmedzené na rovnakú úroveň energie (hlavné kvantové číslo).
V dôsledku toho jadro uplatňuje rastúce účinné jadrové zaťaženie valenčných elektrónov, ktoré sťahuje atómový polomer.
Týmto spôsobom majú nemetalické prvky v rovnakom období tendenciu mať menšie atómové (kovalentné) rádiá.
Zostupovať skupinou
Ak zostupuje skupinou, povoľujú sa nové úrovne energie, ktoré umožňujú elektrónom mať viac priestoru. Elektronický oblak teda pokrýva väčšie vzdialenosti, jeho rozmazaný perifér končí viac od jadra, a preto sa atómový polomer rozširuje.
Môže vám slúžiť: hydroxylová skupinaKontrakcia lantanidu
Elektróny vnútornej vrstvy pomáhajú žiariť efektívne jadrové zaťaženie na valenčných elektrónov. Keď orbitály, ktoré tvoria vnútorné vrstvy.
Táto skutočnosť je uvedená v kontrakcii latanidu v období 6 periodickej tabuľky. Z HF je značná kontrakcia atómového polomeru orbitálov F, ktoré sú „vyplnené“ ako blok F: prechádza sa lantanoidy a aktinoidy.
Podobný účinok je možné pozorovať aj pri prvkoch bloku P z obdobia 4. Tento čas produkt slabého tienenia účinku Drbitálov, ktoré sú vyplnené cestovaním po obdobiach prechodných kovov.
Príklady atómových rádií
V období 2 periodickej tabuľky sú atómové rádiá jej prvkov:
-Li: 257 hod
-BE: 112 PM
-B: 20:00
-C: 77 hod
-N: 74 hod
-O: 186 hod
-F: 184 hod
Všimnite si, že kov lítia má najväčší atómový polomer (257 pm), zatiaľ čo fluór, ktorý sa nachádza na pravom konci obdobia, je najmenší zo všetkých (64 hod.). Atómový polomer zostupuje zľava doprava v rovnakom období a hodnoty zoznamu to ukazujú.
Lítium vytvorením kovových väzieb je jej polomer kovový; a fluorid, ako forma kovalentné väzby (F-F), jeho polomer je kovalentný.
Čo ak chcete vyjadriť atómové rádiá v jednotkách Angstrom? Bude stačiť ich rozdeliť o 100: (257/100) = 2.57 Á. A tak ďalej so zvyškom hodnôt.
Odkazy
- Chémia 301. Atómové polomery. Získané z: CH301.cm.Utexas.Edu
- Nadácia CK-12 (2016). Atómový polomer. Získané z: Chem.Librettexts.orgán
- Trendy v atómových polomeroch. Prevzaté z: úvod.Chem.Ok.Edu
- Clackamas Community College (2002). Atómová veľkosť. Zdroj: DL.klackamy.Edu
- Clark J. (2012). Atómový a iónový polomer. Získané z: Chemguide.co.Uk
- Triasť a Atkins. (2008). Anorganická chémia (štvrté vydanie, s. 23, 24, 80, 169). MC Graw Hill.

