Typy keratínov, štruktúra, umiestnenie a funkcie
- 2012
- 459
- Tomáš Klapka
Ten keratín Je to nerozpustný vláknitý proteín, ktorý je štrukturálnou súčasťou buniek a celkové čísla mnohých organizmov, najmä zvierat stavovcov. Má veľmi rozmanité formy a je málo reaktívne, chemicky povedané.
Jeho štruktúru prvýkrát opísali vedci Linus Pauling a Robert Corey v roku 1951, pričom analyzovali štruktúru vlasov zvierat. Títo vedci tiež naznačili štruktúru myozínu svalového tkaniva
 Schéma organizácie Alfa-Boquin (zdroj: MLPATTON [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Schéma organizácie Alfa-Boquin (zdroj: MLPATTON [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Po kolagéne je to jeden z najdôležitejších proteínov zvierat a predstavuje väčšinu suchej hmotnosti vlasov, vlny, klincov, pazúrov a kopylov, perie, rohov a podstatnej časti vonkajšej vrstvy kože.
„Keratinizované“ prvky zvierat môžu mať veľmi odlišné morfológie, ktoré do veľkej miery závisia od funkcie, ktorú uplatňujú v každom konkrétnom organizme.
Keratín je proteín, ktorý má vlastnosti, ktoré mu dodávajú veľkú mechanickú účinnosť, pokiaľ ide o napätie a kompresiu. Vyrába sa špeciálnym typom buniek, ktoré sa nazývajú „keratinocyty“, ktoré zvyčajne zomrú po ich produkcii.
Niektorí autori potvrdzujú, že keratíny sú vyjadrené na štadióne látky a javiska. U ľudí existuje viac ako 30 kódujúcich gény pre tieto proteíny, ktoré patria do rodiny, ktorá sa vyvinula pre niekoľko kôl genetickej duplikácie.
[TOC]
Typy keratínov a ich štruktúra
V podstate existujú dva typy keratínov: a a β. Tieto sa vyznačujú vlastnením základnej štruktúry, ktorá je primárne zložená z polypeptidových reťazcov, ktoré je možné zaregistrovať ako alfa vrtule (a-queratinas) alebo sa spájajú paralelne ako plastické listy (p-cheap).
α-quatinas
Tento typ keratínu je najviac študovaný a je známe, že cicavce majú najmenej 30 rôznych variantov tohto typu keratínu. U týchto zvierat je a---to súčasťou nechtov, vlasov, rohov, prilby, hrotov a epidermy.
Rovnako ako kolagén, aj tieto proteíny obsahujú v ich štruktúre hojný podiel malých aminokyselín, ako je glycín a alanín, ktoré sú tie, ktoré umožňujú vytvorenie alfa vrtule. Molekulárna štruktúra a-likratínu pozostáva z troch rôznych oblastí: (1) kryštalické vlákna alebo vrtule, (2) terminálne domény vlákien a (3) matrica.
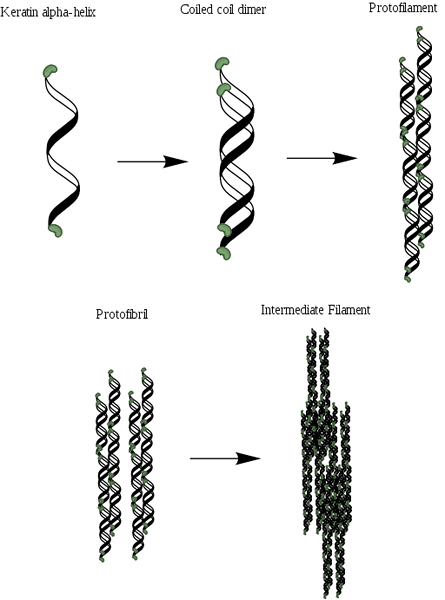
Vrtuláry sú dva a tvoria dimér, ktorý pripomína stočenú špirálu, ktorá zostáva zjednotená vďaka prítomnosti odkazov alebo mostov disulfur (S-S). Každá z vrtule má približne 3.6 aminokyselinový odpad na každom kole, ktorý dáva a pozostáva z viac alebo menej 310 aminokyselín.
Môže vám slúžiť: Flora a fauna ekvádorskej Sierry: Reprezentatívne druhyTieto stočené špirály potom môžu byť spojené s tvorbou štruktúry známeho ako protofilament alebo protofibrilla, ktorá má schopnosť zostaviť sa s ostatnými rovnakým typom.
Protofilamenty majú N- a C-terminálne konce, ktoré sú bohaté na zvyšky cysteínu a ktoré sú pripojené k strednej oblasti alebo matrici. Tieto molekuly polymerizujú za vzniku medziproduktov, ktoré majú priemer blízko 7nm.
Rozlišujú sa dva typy medziproduktov zložených z keratínu: medziprodukčné kyslé vlákna (typ I) a základy (typ II). Tieto sú zabudované do proteínovej matrice a spôsob, akým sa tieto vlákna usporiadajú priamo.
V vláknach typu I sa vrtule navzájom spájajú pomocou troch „špirálových konektorov“ známych ako L1, L12 a L2 a ktoré sa predpokladá, že poskytujú flexibilitu špirálovej doméne. V vláknach typu II sú tiež dve subdomény, ktoré patria medzi špirálové domény.
Príklad štruktúry s a-liktitáciou: vlasy
Ak sa analyzuje štruktúra typických vlasov, má približný priemer 20 mikrónov a je zložená z odumretých buniek.
 Vlasy cicavcov, ako je táto krava, sa skladajú z keratínu (zdroj: Frank Winkler cez Pixabay.com)
Vlasy cicavcov, ako je táto krava, sa skladajú z keratínu (zdroj: Frank Winkler cez Pixabay.com) Makropibrily sú vyrobené z mikrofibríl, ktoré majú menší priemer a sú navzájom spojené prostredníctvom amorfnej proteínovej látky s vysokým obsahom síry.
Tieto mikrofibrily sú skupiny menších protofibríl so vzorom organizácie 9+2, čo znamená, že deväť protofibrilov obklopuje dva centrálne protofibrily; Všetky tieto štruktúry sú v podstate zložené z a-likratínu.
Mäkké keratíny a tvrdé keratíny
V závislosti od obsahu síry, ktorý majú, môžu byť α-queratíny klasifikované ako mäkké keratíny alebo tvrdé keratíny. To súvisí s mechanickou rezistentnou silou uloženou disulfidovými väzbami v proteínovej štruktúre.
V skupine tvrdých keratínov sú zahrnuté tie, ktoré sú súčasťou vlasov, rohov a nechtov, zatiaľ čo mäkké keratíny sú reprezentované vláknami nachádzajúcimi sa v koži a kalusoch.
Disulfidové väzby môžu byť eliminované použitím redukčného činidla, takže štruktúry zložené z keratínu nie sú ľahko stráviteľné zo strany zvierat, pokiaľ nemajú črevá bohaté na tovar, ako je to v prípade niektorých hmyzu.
Môže vám slúžiť: fikológiaP-Oquratinas
Β, ktoré sú oveľa silnejšie ako a-likratíny a nachádzajú sa u plazov a vtákov ako súčasť pazúrov, váh, peria a vrcholov. V Geckos sú z tohto proteínu tiež zložené mikrovingy nachádzajúce sa v ich nohách (huby).
Jeho molekulárna štruktúra je tvorená β-peelovanými plachtami tvorenými antiparalletovými polypeptidovými reťazcami, ktoré sa viažu spolu prostredníctvom väzieb alebo vodíkových mostíkov. Tieto reťazce, vedľa seba, tvoria malé tuhé a ploché povrchy, mierne zložené.
Kde si a aké sú tvoje funkcie?
Keratínové funkcie sú predovšetkým spojené s typom štruktúry, ktorú vytvára a miesto tela zvieraťa, kde sa nachádza.
Rovnako ako iné vláknité proteíny, aj to poskytuje bunkám stabilitu a štrukturálnu tuhosť, pretože patrí do veľkej rodiny proteínu známeho ako rodina medziproduktových vlákien, ktoré sú proteínmi cytoskeletu.
V ochrane a pokrytí
Horná vrstva kože horných zvierat má veľkú sieť medziproduktov vytvorených keratínom. Táto vrstva sa nazýva epidermis a má u ľudí medzi 30 mikrónmi a 1 nm hrubý.
Epiderma funguje ako ochranná bariéra proti rôznym typom mechanického a chemického stresu a je syntetizovaná špeciálnym typom buniek nazývaných „keratinocyty“.
Okrem epidermy existuje ešte viac vonkajšia vrstva, ktorá sa neustále pohybuje.
Espinas a Púas používajú aj rôzne zvieratá na svoju vlastnú ochranu pred dravcami a inými agresormi.
„Brnenie“ pangolíny, niektoré malé hmyzé cicavce, ktoré obývajú Áziu a Afriku, sa skladá aj z „stupníc“ keratínu, ktoré ich chránia.
V obrane a iných funkciách
Rohy sú pozorované u zvierat rodiny Bovidae, tj v kravách, ovčoch a kozách. Sú to veľmi silné a odolné štruktúry a zvieratá, ktoré ich majú zamestnať ako obhajobné a súdne orgány.
Rohy sú tvorené kostným centrom zloženým z „špongiovej“ kosti, ktorá je pokrytá pokožkou, ktorá je vyčnievaná zo zadnej zóny lebky.
 Klince sú ďalším príkladom častí tela zložené z keratínu (zdroj: Adobe Stock cez Pixabay.com)
Klince sú ďalším príkladom častí tela zložené z keratínu (zdroj: Adobe Stock cez Pixabay.com) Pazúry a klince, okrem ich funkcií v potravinách a podpore, tiež slúžia zvieratám ako obrana „zbraní“ proti útočníkom a predátorom.
Môže vám slúžiť: Fixistická teória: koncept, postuláty a autoriVrcholy vtákov spĺňajú niekoľko účelov, medzi ktorými okrem iného okrem iného. Viaceré odrody picos u vtákov sa nachádzajú v prírode, najmä pokiaľ ide o tvar, farbu, veľkosť a pevnosť pridružených čeľustí.
Vrcholy sú zložené, rovnako ako rohy, kostným centrom, ktoré je premietané z lebky a sú pokryté rezistentnými β-likvidnými plachtami.
Zuby neveriacich zvierat („predkov“ stavovcov) sa skladajú z keratínu a rovnako ako zuby „vynikajúcich“ stavovcov majú viac funkcií v potravinách a obrane.
V pohybe
Prilby mnohých prežúvavcov a ugulovaných zvierat (kone, somáre, Alces atď.) Sú zložené z keratínu, sú veľmi odolní a sú navrhnutí na ochranu nôh a spolupracujú v pohybe.
Perie, ktoré tiež používajú vtáky na pohyb, sa skladá z β-aufie. Tieto štruktúry majú navyše funkcie v maskovaní, v súlade, v tepelnej izolácii a v mienkyschopnosti.
 Perie a vrchol vtákov sú tiež zložené z keratínu (zdroj: Couleur, cez Pixabay.com)
Perie a vrchol vtákov sú tiež zložené z keratínu (zdroj: Couleur, cez Pixabay.com) V priemysle
Textilný priemysel je jedným z hlavných vykorisťovateľov keratinizovaných štruktúr, antropocentne sa hovorí. Vlna a vlasy mnohých zvierat sú dôležité na priemyselnej úrovni, pretože s nimi sa vyrábajú rôzne odevy, ktoré sú užitočné pre mužov z rôznych hľadísk.
Odkazy
- Koolman, J., & Roehm, K. (2005). Atlas z biochémie (2. vydanie.). New York, USA: Thieme.
- Mathews, C., Van Holde, K., & Ahern, K. (2000). Biochémia (3. vydanie.). San Francisco, Kalifornia: Pearson.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger princípy biochémie. Vydanie omega (5. vydanie.).
- Pauling, L., & Corey, r. (1951). Štruktúra vlasov, svalov a príbuzných proteínov. Chémia, 37, 261-271.
- Phillips, D., Korge, b., & James, W. (1994). Keratinizácia. Journal of American Academy of Dermatology, 30(1), 85-102.
- Rouse, J. G., & Dyke, m. A. Ísť. (2010). Prehľad biomateriálov na báze keratínu pre biomedicínske aplikácie. Materiál, 3, 999-1014.
- Smith, f. J. D. (2003). Molekulárna genetika porúch keratínu. Am j klin dermatol, 4(5), 347-364.
- Voet, D., & Voet, J. (2006). Biochémia (3. vydanie.). PAN -AMERICKÝ ZDROJE.
- Wang, b., Jang, w., McKitrick, J., & Meyers, m. Do. (2016). Keratín: Štruktúra, mechanické vlastnosti, výskyt biologických organizmov a úsilie o bioinspiráciu. Pokrok v materiálnej vede.
- « Nové Španielsko a vzťahy so svetovým zázemím, trasy
- Opakovacie výučbové charakteristiky, výhody, nevýhody »

