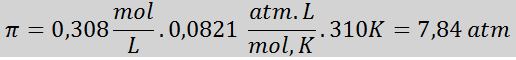Koligatívne vlastnosti riešení
- 678
- 119
- MUDr. Miloslav Habšuda
Čo sú koligatívne vlastnosti?
Ten Kolikačné vlastnosti, Nazývajú sa tiež kolektívne vlastnosti roztokov, sú to skupina štyroch vlastností, ktoré závisia výlučne od množstva častíc prítomných v roztoku, ale nie od povahy týchto častíc.
Inými slovami, tieto vlastnosti vyplývajú z prítomnosti iných častíc, ako je rozpúšťadlo, to znamená častice rozpustenej látky, ale nezávisia od toho, kto je rozpustená látka. Akýkoľvek typ častíc môže viesť k koligatívnym vlastnostiam, bez ohľadu na to, či ide o atómy, ióny alebo molekuly. Jediná vec, na ktorej záleží, je vaša koncentrácia.
Koligatívne vlastnosti sú štyri:
- Rozhodnutie o tlaku pary rozpúšťadla
- Ebulloskopické zvýšenie
- Krioskopický zostup
- Osmotický tlak
Všetky sa vyznačujú tým, že sú úmerné koncentrácii rozpustenej látky v prípade relatívne zriedených roztokov (koncentrácia <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Pozrime sa podrobne každý z týchto štyroch vlastností:
1. Rozhodnutie o tlaku pary rozpúšťadla
Keď sa pripraví roztok neprchavého rozpusteného roztoku, tlak pary výsledného roztoku je vždy menší ako tlak pary čistého rozpúšťadla. Inými slovami, rozpustite neprchavú rozpustenú látku v rozpúšťadle, spôsobuje zníženie tlaku pary uvedeného rozpúšťadla v porovnaní s čistým rozpúšťadlom.
Vzorec poklesu tlaku pary
Rovnako ako všetky koligatívne vlastnosti, aj zníženie tlaku pary (DP) je úmerné koncentrácii rozpustenej látky. Kombináciou Raaultovho zákona s rovnicami molárnej frakcie je možné preukázať, že DP je daný:
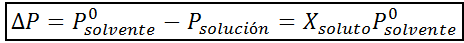
kde p °solventný predstavuje tlak pary čistého rozpúšťadla pri určitej teplote, pRiešenie zodpovedá tlaku pary roztoku a xrozpustenie predstavuje koncentráciu rozpustenej látky vyjadrenej ako molárna frakcia.
Prečo znižuje tlak pary pomocou rozpustenej látky?
Sila, ktorá riadi najprirodzenejšie procesy, ako napríklad odparovanie rozpúšťadla, je zvýšenie entropie alebo úroveň poruchy. Keď sa tekutina odparuje, prechádza z veľmi usporiadaného stavu (v tekutine) na veľmi chaotický (v plyne), pretože v plynovej fáze je oveľa väčšia voľnosť pohybu oveľa viac.
Môže vám slúžiť: fialové skloAvšak v roztoku prítomnosť rozpustenej látky zvyšuje poruchu kvapalnej fázy, pričom neovplyvňuje plynnú fázu (pretože rozpustená látka sa neodparí).
Z tohto dôvodu je rozdiel v úrovni poruchy medzi roztokom a plynnou fázou menší ako medzi čistým rozpúšťadlom a plynnou fázou, takže rozpúšťadlo má menšiu tendenciu odparovať sa v druhom prípade.
Príklad
Problém: S vedomím, že tlak vodnej pary pri určitej teplote je 30,55 mmHg, stanovte tlak pary pripraveného roztoku, ktorý rozpúšťa 720 gramov glukózy (molárna hmotnosť alebo mm = 180 g/mol) v 360 g vody (mm = 18,0 g/mol) pri rovnakej teplote.
Riešenie: V tomto prípade sa musí najskôr vypočítať molárna frakcia rozpustenej látky. Už máme na to všetky potrebné údaje:
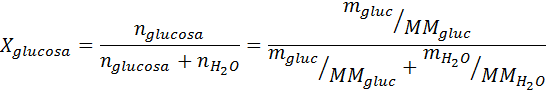
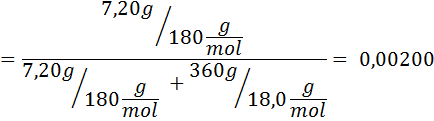
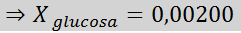
Potom sa použije rovnica poklesu tlaku pary.
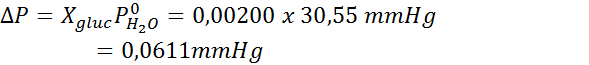
Teraz určujeme nový tlak pary rozpúšťadla:
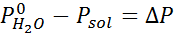
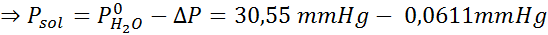
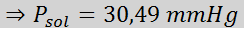
2. Ebulloskopické vyvýšenie alebo bod varu
Ebulloskopické zvýšenie sa týka zvýšenia bodu varu roztoku v porovnaní s bodom varu čistého rozpúšťadla. Aby ste pochopili, prečo sa to stane, nezabudnite, že bod varu je definovaný ako teplota, pri ktorej sa tlak pary kvapaliny vykonáva rovnajúca sa atmosférickému tlaku.
Pretože roztoky majú menší tlak pary ako čisté rozpúšťadlo (ako sme práve videli v predchádzajúcej časti), je potrebné ho viac zahrievať, aby bolo možné dosiahnuť atmosférický tlak, a tak dosiahnuť jeho bod varu. Z tohto dôvodu je bod varu roztokov (s neprchavými rozpustenými látkami) vždy väčší ako bod čistého rozpúšťadla.
Ebulloskopický vzorec
Zvýšenie bodu varu (DTb) Je úmerná koncentrácii rozpustenej látky vyjadrenej v molialite, ako je naznačené nasledujúcou rovnicou:
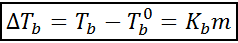
Kde tb Je to bod varu roztoku, tb° je to bod varu čistého rozpúšťadla, kb Je to ebullloskopická konštanta rozpúšťadla a m Je to molealita rozpustenej látky.
Príklad
Problém: S vedomím, že varenie konštanty vody je 0,52 ° C.kg/mol, stanovte bod varu roztoku glukózy pripraveného v predchádzajúcom príklade.
Riešenie: Na určenie ebullloskopického zvýšenia potrebujeme iba morálku.
Môže vám slúžiť: oxid cínu (ii): Štruktúra, vlastnosti, nomenklatúra, použitia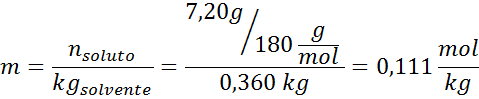
Teraz aplikujeme vzorec DTb:
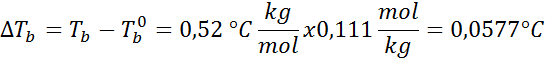
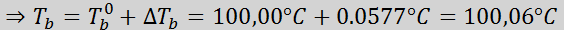
3. Krioskopický zostup
Kryoskopické zníženie je zníženie bodu zmrazenia roztoku v porovnaní s bodom zmrazenia čistého rozpúšťadla. Dôvod, prečo sa to stane, je podobný ebullloskopickému zvýšeniu a má svoj pôvod v znížení tlaku pary.
Táto vlastnosť sa široko používa v chladnom počasí, kde v zime sneží. V týchto krajinách je veľmi bežné, že nákladné vozidlá šíria soli ako NaCl alebo CACL2 na cestách alebo na verejných lavičkách, po ktorých sa sneh topí. Dôvod, prečo sa topí, je to, že soľ znižuje bod zamrznutia vody.
Krioskopický pôvod
Chrioskopická zostupná rovnica je veľmi podobná rovine ebulloskopického zvýšenia. Je tiež úmerná morálnej koncentrácii a v tomto prípade závisí od kryoskopickej konštanty rozpúšťadla.
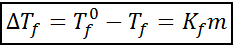
kde tF Je to bod mrazu roztoku, tF° je to bod mrazu čistého rozpúšťadla, kF Je to chrioskopická konštanta rozpúšťadla a m Je to molealita rozpustenej látky.
Príklad
Problém: S vedomím, že kryoskopická vodná konštanta je 1,86 ° C.kg/mol, stanovte bod zmrazenia roztoku glukózy pripraveného v predchádzajúcom príklade.
Riešenie: Morálka riešenia už bola stanovená, takže môžeme priamo určiť DTF pomocou predchádzajúceho vzorca:
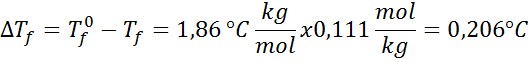
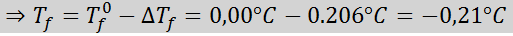
4. Osmotický tlak
Osmóza je proces s veľkým významom na chemickej a biologickej úrovni. Toto pozostáva z toku molekúl rozpúšťadla (napríklad vody) z zriedeného roztoku do iného koncentrovanejšieho roztoku, keď sú oddelené pomocou semiperpermovateľnej membrány (čo umožňuje iba prejsť rozpúšťadlom, ale nie rozpustenej látky).
Táto tendencia „absorbovať“ rozpúšťadlo cez semipermekuteľnú membránu je vlastnosť, ktorá závisí výlučne od celkovej koncentrácie častíc rozpustených látok prítomných v roztoku, bez ohľadu na to, o akú rozpustenú látku je. Z tohto dôvodu je tento trend koligatívnou vlastnosťou a meria sa prostredníctvom osmotického tlaku.
Osmotický tlak (π) je tlak, ktorý by sa mal vyvíjať na roztok na zastavenie osmózy. Čím väčší je osmotický tlak, tým väčšia tendencia, roztok absorbuje rozpúšťadlo (alebo presnejšie, tým viac trendu rozpúšťadla sa šíri smerom k tomuto roztoku) má roztok).
Môže vám slúžiť: horčík: história, štruktúra, vlastnosti, reakcie, použitiePrečo sa vyskytuje osmóza?
Vysvetlenie procesu osmózy je veľmi jednoduché. Všetky látky majú tendenciu šíriť sa z miesta, kde sú viac koncentrovanej. Toto sa hovorí, aby ste sledovali váš koncentračný gradient.
Ak je roztok koncentrovanejší v rozpustení, zároveň je zriedený v rozpúšťadle a naopak. Z tohto dôvodu má rozpúšťadlo prirodzenú tendenciu prechádzať z najviac zriedeného roztoku (kde je rozpúšťadlo koncentrovanejšie) smerom k najkoncentrovanejšiemu roztoku (kde je zriedenejšie).
Receptúra osmotického tlaku
Osmotický tlak sa dá vypočítať s vzorcom veľmi podobným rovnici ideálnych plynov:
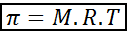
V tejto rovnici je π osmotický tlak, M je molárna koncentrácia rozpustenej látky, r je univerzálna konštanta ideálnych plynov (0,0821 ATM.L/mol.K) a t je absolútna teplota v k.
Osmotický tlak a tonicita
Osmotický tlak je veľmi dôležitý pre fungovanie ľudského tela. V skutočnosti sa soľné roztoky, ktoré sa injikujú intravenózne.
- Menej koncentrovaný roztok, v ktorom má plazma nižší osmotický tlak a je to povedané Hypotonický roztok.
- Ak máte rovnakú celkovú koncentráciu rozpustených látok, ako sa hovorí izotonické riešenie.
- Ak máte väčší osmotický (alebo koncentračný) tlak, je to povedané hypertonické riešenie.
Príklad
Problém: Vypočítajte osmotický tlak pri 310 K 0,9% roztoku soľného roztoku (m/v), ktorý je izotonický s krvnou plazmou.
Riešenie: Už máme teplotu, takže jediné, čo chýba, je určiť molárnu koncentráciu častíc soli (NaCl) v roztoku. Pre to.
Každých 100 ml roztoku obsahuje 0,9 g NaCl, takže:
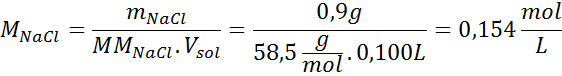
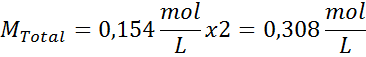
Toto je celková koncentrácia rozpustených častíc v roztoku, takže teraz môžeme vypočítať osmotický tlak: