Medzimolekulárne sily
- 4940
- 1201
- Mgr. Pravoslav Mokroš
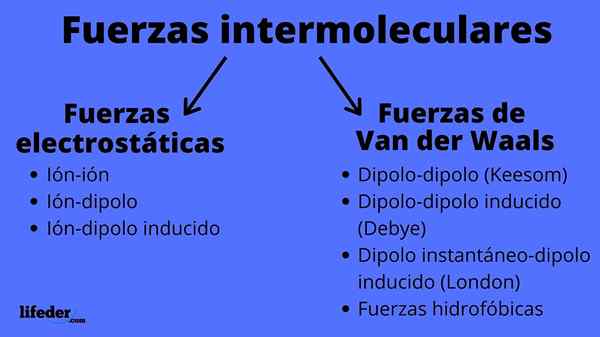
 Schéma typov medzimolekulárnych síl
Schéma typov medzimolekulárnych síl Čo sú medzimolekulárne sily?
Ten Medzimolekulárne sily Sú to súbor interakcií, ktoré sa uskutočňujú medzi molekulami, či už z rovnakej chemickej zlúčeniny alebo nie, a ktoré ich udržiavajú pohromade. Vďaka týmto silám sa molekulám podarí zoskupiť a definovať pevnú, kvapalinu alebo plyn; to znamená, že sú zodpovední za fyzikálne vlastnosti látok.
Intermolekulárne sily môžu byť dvoch typov: elektrostatické alebo van der Waals. Elektrostatické sú všetky tie, v ktorých máme ióny, ktoré sú elektricky zaťažené atómy alebo molekuly (+ alebo -). Medzitým sú atómy van der Waals neutrálne atómy alebo molekuly, ktoré sú kolísaním ich elektronickej distribúcie polarizované a priťahované alebo odrazené navzájom.
Intermolekulárne sily sa dajú porovnávať s existujúcim zväzkom medzi rôznymi kúskami laikov. V závislosti od ich foriem a usmernení sa ich odbory stanú slabšími alebo slabšími, rovnako ako menia dizajn a konečné rozmery výstavby.
Čím silnejšie sú tieto sily, tým ťažšie bude oddeliť kúsky laikov alebo, v prípade chémie, molekuly. To tiež znamená, že dôjde k väčšiemu zhutneniu a že molekuly budú definovať viskóznejšie kvapaliny, ťažšie alebo hustejšie plyny.
Ďalšie fyzikálne vlastnosti, ako sú body fúzie a varu, volatilita, textúra atď., Sú to tiež makroskopické reflexy intermolekulárnych síl, ktoré riadia molekuly alebo ióny zlúčeniny alebo zmesí. Napríklad: Intermolekulárne sily plynov sú veľmi slabé v porovnaní s kameňmi.
Pochopenie intermolekulárnych síl je nevyhnutné na opis mnohých chemických, fyzikálnych a biologických konceptov.
Elektrostatické sily
Iónový ión
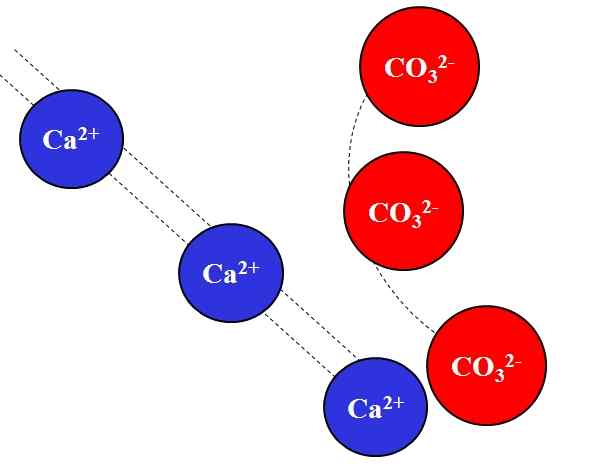 Elektrostatická príťažlivosť medzi iónmi Ca2+ a CO32-. Zdroj: Gabriel Bolívar.
Elektrostatická príťažlivosť medzi iónmi Ca2+ a CO32-. Zdroj: Gabriel Bolívar. Opačné poplatky Ióny priťahujú veľkou silou, čo je spôsobené Coulombovým zákonom a rýchlo klesá, čím viac sa ióny vzdialia.
Napríklad ión CA2+ Je to kladný náboj, katión, zatiaľ čo CO32- Je to negatívny zaťaženie, anión. Byť tvojím opačným zaťažením, CA2+ a co32- Priťahujú sa navzájom, čo dokazuje, že čím bližšie sú, tým viac zostanú.
Naopak, ióny s rovnakým zaťažením, či už pozitívne alebo negatívne, odpudzujú rovnakou silou, ale v opačnom zmysle. Takto CA2+ Odrazovanie ión ako na+, Mg2+, Klimatizovať+, atď., Pokiaľ neexistujú iné anióny, ktoré znižujú odpudenie.
Môže vám slúžiť: dibenzalacetona: vlastnosti, reakčný mechanizmus, použitie, rizikáZo všetkých medzimolekulárnych síl sú sily typu iónov iónov najjednoduchšie; Ale zároveň najsilnejší zo všetkých. Na oddelenie iónov je potrebných veľa energie alebo tepla.
Iónový dipolo
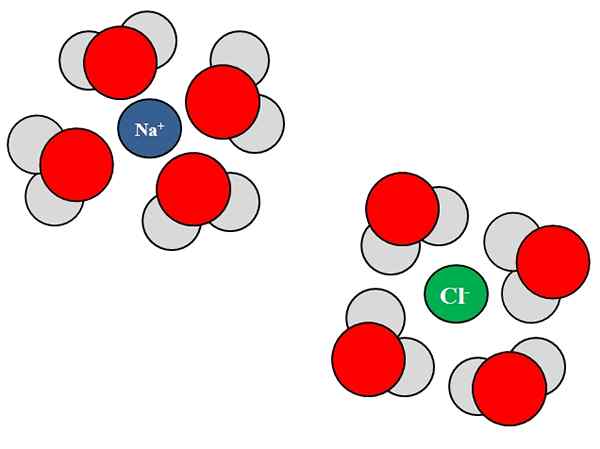 Iónové dipolo interakcie medzi molekulami vody a iónmi NaCl. Zdroj: Gabriel Bolívar.
Iónové dipolo interakcie medzi molekulami vody a iónmi NaCl. Zdroj: Gabriel Bolívar. Ióny môžu tiež interagovať s neutrálnymi atómami alebo molekulami, ako je voda. Platí to najmä pokiaľ ide o molekuly rozpúšťadla, ktoré solvata, to znamená, obklopuje ióny v ich kvapaline.
Napríklad chlorid sodný, NaCl, pozostáva z NA iónov+ a cl-. Keď sa ich kryštály hodia do vody, molekuly vody, h2O alebo hoh, hydratovať alebo obklopovať ióny NaCl; Ale spôsob, akým sa líši v závislosti od príslušných iónov.
Preto vidíme na vynikajúcom obraze, že ión NA+ je hydratovaný atómami kyslíka HH2Ani. Medzitým ión CL- je hydratovaný atómami vodíka.
Pretože? Pretože voda je polárna látka, čo znamená, že má dipól: pól s pozitívnym čiastočným zaťažením a ďalšia s negatívnym čiastočným zaťažením.
Atóm kyslíka, pretože je viac elektronegatívny, priťahuje elektróny k sebe, čím sa elektróny častejšie lokalizujú okolo tohto atómu; Niečo, čo sa nestane rovnako s atómami vodíka, menej elektronegatívne. Kyslík, pretože je negatívnejší, je orientovaný na NA+; Zatiaľ čo vodíny, pretože sú pozitívnejšie, sú orientované na CL-, Pretože opačné poplatky sú priťahované.
Indukovaný ión-dipolo
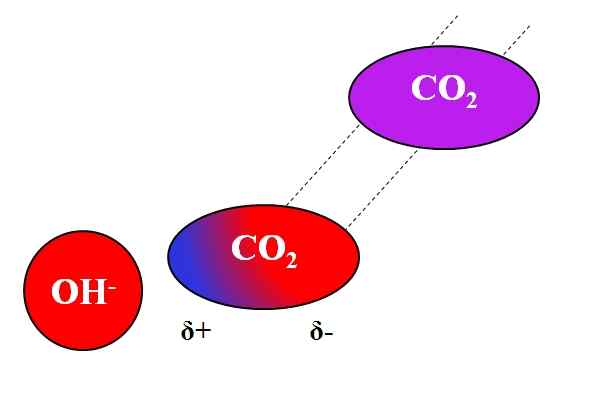 Indukčný účinok OH- na molekulu CO₂. Zdroj: Gabriel Bolívar.
Indukčný účinok OH- na molekulu CO₂. Zdroj: Gabriel Bolívar. S iónmi môžu interagovať nielen molekuly polárnych alebo dipólov. Pre neutrálne atómy alebo molekuly, aj keď nemajú dipóly, je distribúcia ich elektrónov náchylná na induktívne účinky blízkych iónov; to znamená, že ióny spôsobujú okamih a krátku polarizáciu, dosť na pozoruhodnú interakciu.
Môže vám slúžiť: octanu olovo: štruktúra, vlastnosti, získanie, použitiePredpokladajme napríklad interakciu medzi OH iónom- A CO2. CO2 Je to neutrálna zlúčenina, ktorej molekula (vo fialovej) chýba dipól. Avšak, ako sa blíži OH-, Záporné zaťaženie tohto odpudzovania elektrónov atómov kyslíka CO2.
Čím bližšie je OH- A CO2, Silnejší bude odpudil. V dôsledku toho sa začína ustanoviť dipól vyvolaný OH- O CO2. Pozitívny pól sa javí ako A+, pretože elektróny, odrazené, „emigrujú“ na druhý koniec molekuly.
Tak, oh- A CO2 Zostávajú dosť spolu na to, aby reagovali medzi sebou. To je dôvod, prečo co2 Je obzvlášť rozpustný v alkalických roztokoch.
Van der Waals sily
Sily Van der Waals v zásade sa vzťahujú iba na tie, ktoré existujú medzi neutrálnymi atómami alebo molekulami, bez iónových zaťažení.
Dipolo-Dippolo (Keesom)
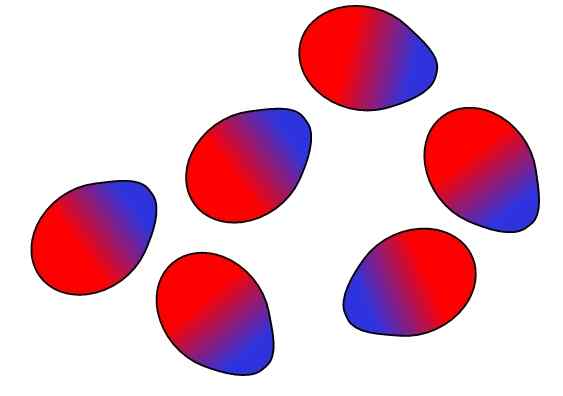 Sily dipbola. Zdroj: Gabriel Bolívar.
Sily dipbola. Zdroj: Gabriel Bolívar. Priťahujú sa protichodné poplatky, rovnaké zaťaženia odpudzujú. To isté platí pre dipóly: priťahujú sa protiľahlé póly (δ+ a δ-), zatiaľ čo rovnaké póly odrážajú. Pozitívne póly alebo δ+ sú znázornené vyššie s modrou farbou, ale záporné póly alebo δ- sú reprezentované s červenou farbou.
Všimnite si, ako sú horné molekuly orientované a nariadené tak, aby boli opačné póly, ktoré sa v procese presúvajú k rovnakým pólom. Toto usporiadanie je to, čo je známe ako interakcie alebo sily dipbolo-dipolo (sily Keesom) a sú najdôležitejšími intermolekulárnymi silami medzi polárnymi molekulami.
Napríklad H molekuly2Alebo, HCl, HF, Co, sú okrem iného usporiadané v podobných režimoch. Čím viac sú polárnejšie, tým silnejšie budú jeho dipólové-dipolo sily; A preto ťažšie bude oddeliť svoje molekuly.
HF je viac polárny ako HCL, takže bod varu HF je vynikajúci (19.5 ° C) do HCl (-85.05 ° C). Je neuveriteľný účinok, ktorý majú medzimolekulárne sily na fyzikálne vlastnosti. Najmenšia variácia a látka sa bude správať úplne odlišná od toho, čo sa očakávalo.
Môže vám slúžiť: plynný stav: Charakteristiky, všeobecné právo, príkladyIndukované dipolo-dipolo (Debye)
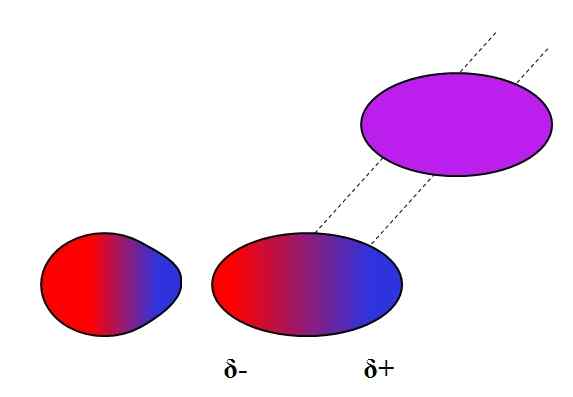 Vyvolaný dipolo. Zdroj: Gabriel Bolívar.
Vyvolaný dipolo. Zdroj: Gabriel Bolívar. Dipolos, podobne ako ióny, môžu tiež kolísať alebo ovplyvniť elektronické rozdelenie neutrálnych atómov alebo molekúl. Preto vidíme na vynikajúcom obraze, že dipól náhle polarizuje neutrálnu molekulu. Preto sa hovorí, že ide o indukovanú silu dipólu-dipól, pretože druhý dipól je okamžitý, nie trvalý.
Napríklad voda je schopná rozpustiť malé množstvo alebo2, Ale dosť na to, aby morská fauna dýchala. Ak h2Alebo nemohol vyvolať dipól v O2, Celý kyslík moria by unikol povrchu, pretože medzi oboma molekulami by neexistovali žiadne interakcie.
Okamžitý dipolo vyvolaný dipolo (Londýn)
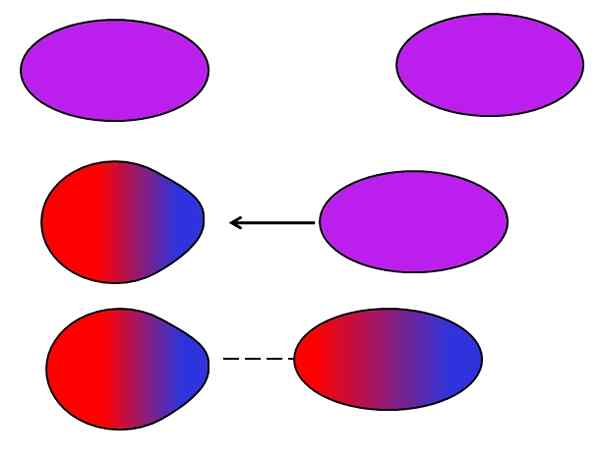 Londýnske sily. Zdroj: Gabriel Bolívar.
Londýnske sily. Zdroj: Gabriel Bolívar. Neutrálne atómy alebo molekuly nepotrebujú susedné ióny alebo dipóly, aby utrpeli výkyvy pri distribúcii svojich vnútorných zaťažení. Elektróny nie sú stále, ale pohybujú sa po celej molekule. V určitom okamihu sa uskutoční okamžitý dipól, ktorý, ak je veľmi blízko k neutrálnej molekule alebo atómu, vyvolá dipól v nich (pozri vyššie).
Čím väčšie a asymetrické tieto molekuly, tým pravdepodobnejšie sa objavia okamžité dipóly. Z tohto dôvodu majú zlúčeniny najvyšších atómových hmôt vyvolané intenzívnejšie intenzívne sily vyvolané dipolom. Tento typ sily van der Waals je známy ako londýnske sily.
Napríklad ušľachtilé plyny (on, NE, AR atď.) Zostávajú zjednotené vďaka londýnskym silám, rovnako ako vzduchové plyny (alebo2, N2, Co2, atď.). Táto sila je tiež najdôležitejšou medzi uhľovodíkmi, ako je metán, Cho4, A propán, Cho3Chvály2Chvály3.
Hydrofóbne sily
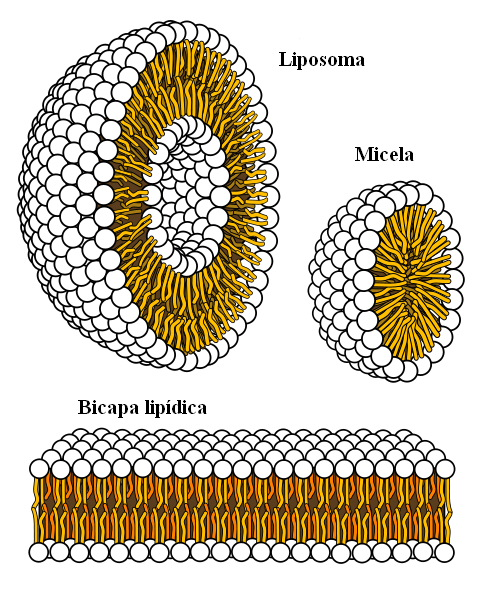 Supramolekulárne štruktúry pochádzajú z hydrofóbnych síl
Supramolekulárne štruktúry pochádzajú z hydrofóbnych síl Nakoniec máme hydrofóbne sily, ktoré sú osobitným výsledkom londýnskych síl a odrazov medzi látkami s rôznymi polaritami. Tuky sú málo príbuzné s vodou, takže v tomto je nerozpustný.
Molekuly tukov sa snažia zoskupovať takým spôsobom, že ich interakcie s vodou sú čo najviac, a to dokáže tvoriť 3D štruktúry, aké sú uvedené vyššie.
Molekuly tukov, ako sú fosfolipidy, sa teda spájajú a vytvárajú lipidové dvojvrstvy, micely a lipozómy.
Ak sú pozorované, tieto molekuly majú bielu hlavu, ktorá predstavuje polárnu časť súvisiacu s vodou; ako aj apolárny chvost, ktorý odpudzuje molekuly vody. Čiary sa snažia umiestniť do týchto supramolekulárnych štruktúr, aby neinteragovali s vodou.

