Izobarické procesné vzorce, rovnice, experimenty, cvičenia

- 1345
- 305
- MUDr. Miloslav Habšuda
V izobarický proces, tlak P systému zostáva konštantný. Predpona „ISO“ pochádza z gréčtiny a používa sa na označenie toho, že niečo zostáva konštantné, zatiaľ čo „Baros“, tiež z gréčtiny, znamená váhu.
Izobarické procesy sú úplne vlastné v uzavretých kontajneroch aj v otvorených priestranstvách, ktoré sú jednoduché ich lokalizovať v prírode. S tým máme na mysli, že fyzikálne a chemické zmeny sú možné na pozemskom povrchu alebo chemických reakciách v otvorených nádobách na atmosféru.
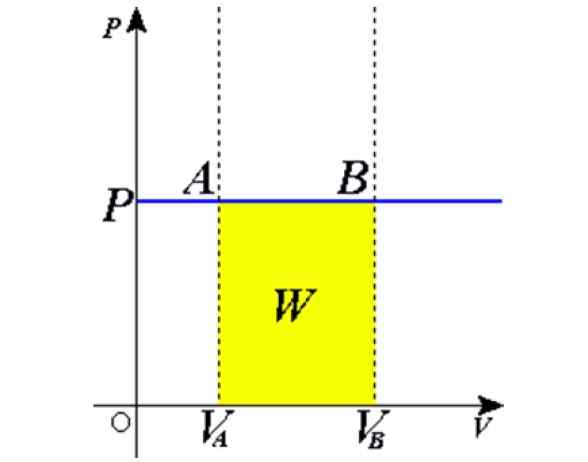 postava 1. Izobarický proces: Modrá vodorovná čiara je izobara, čo znamená konštantný tlak. Zdroj: Wikimedia Commons.
postava 1. Izobarický proces: Modrá vodorovná čiara je izobara, čo znamená konštantný tlak. Zdroj: Wikimedia Commons. Niektoré príklady sa získavajú zahrievaním na slnko Balón plný vzduchu, varenie, varenie alebo mrazivé vodu, paru, ktorá sa generuje v kotlach alebo proces zdvihnutia horúci vzduchový balón. Neskôr uvedieme vysvetlenie týchto prípadov.
[TOC]
Vzorec a rovnice
Odvodzujeme rovnicu pre izobarický proces za predpokladu, že študovaný systém je ideálny plyn, pomerne vhodný model pre takmer akýkoľvek plyn pri menej ako 3 tlakových atmosférach. Častice ideálneho plynu sa pohybujú náhodne, zaberajú celý objem priestoru, ktorý ich obsahuje bez vzájomného interakcie.
Ak sa ideálny plyn zamknutý vo valci vybavený pohyblivým piestom sa môže pomaly rozširovať, možno predpokladať, že jeho častice sú vždy v rovnováhe. Potom plyn vyvíja na piest v oblasti Do sila F Rozsah:
F = p.Do
Kde p Je to tlak plynu. Táto sila uplatňuje prácu, ktorá vytvára nekonečné posunutie Dx V pieste, ktorý dal:
dw = fdx = pa.Dx
Ako produkt ADX Je to objemový diferenciál DV, tak DW = PDV. Zostáva integrovať obe strany z počiatočného objemu VložkaDo Do konečného zväzku VložkaB Získanie celkovej práce vykonanej plynom:


[TOC]
Experimenty
Popísaná situácia sa overuje experimentálne konfigurácia plynu vo valci vybavenej pohyblivým piestom, ako je znázornené na obrázkoch 2 a 3. Piest je umiestnený na piest, ktorého hmotnosť je nasmerovaná nadol, zatiaľ čo plyn vyvíja silu vďaka tlaku P, ktorý produkuje na piest.
Môže vám slúžiť: IMANTÁCIA: Čo pozostáva, metóda a príklady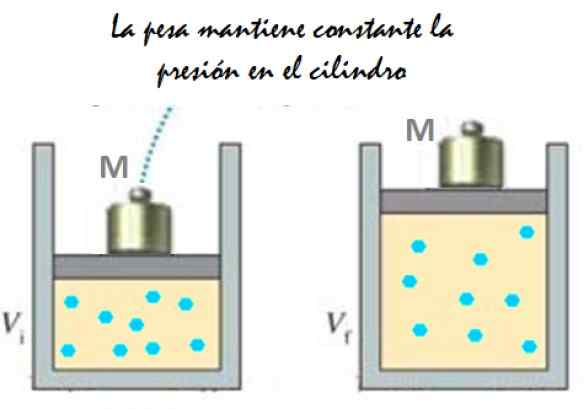 Obrázok 2. Experiment, ktorý pozostáva z rozširovania plynu konštantného tlaku. Zdroj: f. Zapata.
Obrázok 2. Experiment, ktorý pozostáva z rozširovania plynu konštantného tlaku. Zdroj: f. Zapata. Pretože piest je schopný voľne sa pohybovať, objem, ktorý zaberá plyn, sa môže zmeniť bez problémov, ale tlak zostáva konštantný. Pridanie atmosférického tlaku PBankomat, To tiež vyvíja silu, máte:
Mg - p.A + PBankomat . A = konštanta
Preto: p = (mg/a) + pBankomat Nemení sa, pokiaľ nie je modifikovaná hmotnosť. Pridanie tepla do valca, plyn rozšíri zvýšenie objemu alebo sa sťahuje pri extrakcii tepla.
Izobarické procesy v ideálnom plyne
Ideálna rovnica stavu plynu sa týka premenných dôležitosti: tlak P, objem V a teplota T:
P.V = n .R.Tón
Tu n predstavuje počet mólov a R je konštanta ideálnych plynov (platných pre všetky plyny), ktorá sa vypočíta vynásobením Boltzmannovej konštanty pomocou agadro čísla, čo vedie k:
R = 8.31 j/mol k
Ak je tlak konštantný, štátna rovnica môže byť napísaná ako:
V/t = nr/p
Ale nr/p je konštantné, pretože n, r a p sú. Takže keď systém prejde z jedného štátu 1 do druhého štátu 2, vznikne nasledujúci podiel, známy tiež ako Charlesov zákon:
Vložka1/T1 = V2/T2
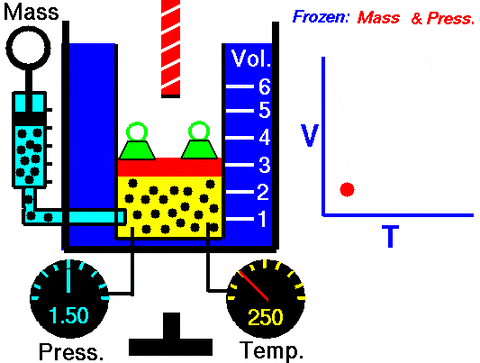 Obrázok 3. Animácia, ktorá ukazuje rozširovanie plynu konštantného tlaku. Vpravo graf objemu v závislosti od teploty, čo je čiara. Zdroj: Wikimedia Commons. Výskumné centrum NASA Glenn [Public Domain].
Obrázok 3. Animácia, ktorá ukazuje rozširovanie plynu konštantného tlaku. Vpravo graf objemu v závislosti od teploty, čo je čiara. Zdroj: Wikimedia Commons. Výskumné centrum NASA Glenn [Public Domain]. Výmena W = PAV, Práca, ktorá sa vykonávala zo stavu 1 na 2, z hľadiska konštánt a variácie teploty, ľahko merateľná pomocou teplomeru:
W1 → 2 = nr (t2 - Tón1) = nr.Δt
Na druhej strane, prvý zákon termodynamiky to ustanovuje:
∆U = q - w
To znamená, že pridanie do plynu Určité množstvo tepla Q sa zvyšuje vnútorná energia ∆U a zvyšujú sa vibrácie jeho molekúl. Týmto spôsobom plyn rozširuje a vykonáva prácu vytesňovaním piestu, ako sme už povedali.
V ideálnom monoatomickom plyne a variácii vnútornej energie ∆U, ktorá zahŕňa kinetickú energiu a potenciálnu energiu jej molekúl, je:
∆U = (3/2)Nr Δt
Nakoniec kombinujeme v jednom výrazy, ktoré sme získali:
Otázka = ∆U + W = (3/2)Nr Δt + Nr∆t = (5/2) Nr Δt
Alternatívne to je možné prepísať z hľadiska hmotnosti m, teplotného rozdielu a novej konštanty nazývanej Špecifické teplo teploty Pri konštantnom tlaku skrátene Cp, ktorých jednotky sú J/mol K:
Môže vám slúžiť: Venuša (planéta)Q = m cp ∆t
Príklady
Nie všetky izobarické procesy sa vykonávajú v uzavretých nádobách. V skutočnosti sa vyskytujú nespočetné termodynamické procesy všetkých druhov atmosférického tlaku, takže izobarické procesy sú svojou povahou veľmi časté. To zahŕňa fyzikálne a chemické zmeny na zemskom povrchu, chemické reakcie v otvorených nádobách a oveľa viac.
Aby sa izobarické procesy vyskytli v uzavretých systémoch, je potrebné, aby ich hranice boli dostatočne flexibilné, aby umožnili zmeny objemu bez menenia tlaku.
To sa stalo v piestovom experimente, ktorý sa ľahko pohyboval, keď sa plyn rozšíril. To isté sa stáva uzavretím plynu na večierku pre večierky alebo horúcim vzduchom.
Tu máme niekoľko príkladov izobarických procesov:
Varte vodu a varte
Vriaca voda pre čaj alebo omáčky na varenie v otvorených nádobách sú dobrými príkladmi izobarických procesov, pretože každý sa vyvíja pri atmosférickom tlaku.
Pri zahrievaní vody, teploty a objemu sa zvyšuje a ak sa teplo pokračuje, konečne sa dosiahne bod varu, v ktorom dôjde k zmene vodnej fázy. Aj keď k tomu dôjde, teplota zostáva tiež konštantná 100 ° C.
Zmraziť vodu
Na druhej strane, mrazivosť vody je tiež izobarický proces, či už sa koná v jazere počas zimy alebo v domácej chladničke.
Zohrejte balón plný vzduchu na slnko
Ďalším príkladom izobarického procesu je zmena objemu balóna nafúknutého vzduchu, keď je ponechaný vystavený slnku. Prvá vec ráno, keď nie je príliš horúca, zemeguľa má určitý zväzok.
Ako čas plynie a teplota sa zvyšuje, glóbus tiež zahreje svoj objem a to všetko sa deje pri konštantnom tlaku. Globe Material je dobrým príkladom hranice dostatočne flexibilného na to, aby sa vzduch vo vnútri, keď sa vyhrieva, rozširuje bez úpravy tlaku.
Skúsenosti sa dá vykonať aj úpravou zemegule bez toho, aby sa na vrchole sklenenej fľaše plnej fľaše s tretinou vody, ktorá sa zahrieva na Maria Bio of Mary. Hneď ako sa voda zahrieva, balón sa okamžite nafúkne, ale starostlivosť by sa nemala príliš zohriať, aby sa nevybuchla.
Aerostatický balón
Je to plávajúca loď bez pohonu, ktorá využíva vzduchové prúdy na prepravu ľudí a predmetov. Globe je zvyčajne naplnená horúcim vzduchom, ktorý je chladnejší ako okolitý vzduch, stúpa a rozširuje, aby sa zemeguli drsné.
Môže vám slúžiť: Triple PointZatiaľ čo vzduchové prúdy priamo na zemeguľu majú horáky, ktoré sú aktivované na zahriatie plynu, keď chcete vystúpiť alebo udržiavať výšku, a deaktivujú sa pri zostupe alebo pristátí. To všetko sa deje pri atmosférickom tlaku, predpokladaného konštantného v určitej výške neďaleko povrchu.
 Obrázok 4. Horúci vzduch. Zdroj: Pixabay.
Obrázok 4. Horúci vzduch. Zdroj: Pixabay. Kotly
V kotlách sa para vytvára vykurovaním vody a udržiavaním konštantného tlaku. Potom táto para vykonáva použiteľnú prácu, napríklad výrobu elektriny v termoelektrických rastlinách alebo pôsobenie iných mechanizmov, ako sú lokomotívy a vodné čerpadlá.
Vyriešené cvičenia
Cvičenie 1
Pri teplote 27 ° C je 40 litrov plynu. Nájdite nárast objemu pri pridávaní tepelného izobáricky, až kým nedosiahne 100 ° C.
Riešenie
Charlesov zákon sa používa na určenie konečného objemu, ale pozornosť: Teploty sa musia vyjadriť v Kelvin, stačí k každému pridať 273 K:
27 ° C = 27 + 273 K = 300 K
100 ° C = 100 + 273 K = 373 K
Od:
Vložka1/T1 = V2/T2 ⇒ V2 = T2(V1/T1) = 373 ° C (40 l/300 K) = 49.7 l
Nakoniec zvýšenie objemu je V2 - Vložka1 = 49.7 l - 40 l = 9.7 l.
Cvičenie 2
5 sa dodáva 5.00 x 103 J z energie na ideálny plyn na výrobu 2.00 x 103 J práce vo vašom prostredí v izobarickom procese. Žiada sa, aby ste našli:
a) Zmena vnútornej energie plynu.
b) Zmena objemu, ak teraz vnútorná energia klesá o 4.50 x 103 J a 7 sú vylúčení.50 x 103 J systému, berúc do úvahy konštantný tlak 1.01 x 105 Pav.
Roztok
Použitý ∆U = q - w a hodnoty uvedené vo vyhlásení sú nahradené: Q = 5.00 x 103 J a w = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Vnútorná energia plynu sa preto zvyšuje o 3.00 x 103 J.
Riešenie B
Zmena objemu sa nachádza v hotovej práci: W = p∆v:
∆U = q - w = q - Pudz
Vyhlásenie potvrdzuje, že vnútorná energia sa znižuje, preto: ∆U= -4.50 x 103 J. Tiež nám hovorí, že určité množstvo tepla je vylúčené: q = -7.50 x 103 J. V obidvoch prípadoch negatívny znak predstavuje zníženie a stratu, potom:
-4.50 x 103 J = -7.50 x 103 J - p∆v
Kde P = 1.01 x 105 Pav. Pretože všetky jednotky sú v medzinárodnom systéme, zmena objemu je jasná:
∆v = (-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 Pav) = -2.97 x 10-2 m3
Pretože zmena objemu je negatívna, znamená to, že objem sa znížil, to znamená, že systém sa stlačil.
Odkazy
- Byjou. Izobarický proces. Získané z: Byjus.com.
- Cengel a. 2012. Termodynamika. 7. vydanie. McGraw Hill.
- XYZ proces. Dozviete sa viac o izobarickom procese. Získané z: 10 procesov.X a z.
- Serway, r., Vulle, C. 2011. Základy fyziky. 9NA ED. Učenie sa.
- Wikipedia. Plynové zákony. Obnovené z: je.Wikipedia.orgán.
- « 14 psychologických experimentov s veľmi kontroverznými ľuďmi
- Koncept, typy a príklady emapovania »

