Základy potenciometrie, rovnice, elektródy

- 3327
- 366
- MUDr. Žigmund Boška
Ten Potenciometria Je to technika elektrochemickej analýzy, ktorá je založená na meraní napätia, média alebo kompartmentu, s ktorou sa určuje aktivita alebo koncentrácia druhu (iónového alebo molekulárneho). Je to nerezštruktívna technika, pretože sa nesnaží modifikovať chemickú povahu príslušného analytu.
Na vykonanie tejto analýzy sú nevyhnutné najmenej dve elektródy: jeden z referenčných a iný ukazovateľ alebo práca. Podobne musí existovať vysoký impedančný voltmeter, s ktorým sa napätie merajú bez toho, aby sa medzi dvoma elektródami a roztokmi, ktoré ich obklopujú.
 Všeobecné zastúpenie potrebných prvkov pre potenciometrickú analýzu. Zdroj: Gabriel Bolívar.
Všeobecné zastúpenie potrebných prvkov pre potenciometrickú analýzu. Zdroj: Gabriel Bolívar. Vyššie máme všeobecné znázornenie zostavy pre potenciometrickú analýzu. V oddelení, kde sa zavádza indikátorová elektróda, je druh, ktorého koncentráciu chceme určiť; Zatiaľ čo v referenčnej elektróde máme ďalšie riešenie, v ktorom poznáme koncentrácie jeho komponentov.
Registrované čítanie napätia je v zásade spôsobené druhom záujmu, ktorý sa blíži k indikátorovej elektróde. S týmto napätím vypočítame koncentráciu tohto druhu, napríklad koncentráciu CA iónov2+, Zápis+, H+, Nat+, Klimatizovať+, Cl-, atď. Potentiometria preto využíva v klinickom, environmentálnych, analytických a fyzikálno -chémii chémie.
[TOC]
Základy
Napätie, ktoré je určené v potenciometrických analýzach, je napätie bunky abunka, čo je rozdiel medzi napätím spôsobenými dvoma elektródami, indikátorom a referenciou. Elektródy sú citlivé na aktivity molekúl alebo iónov, ktoré ich obklopujú, sú schopné ich prijať elektróny alebo naopak, priniesť ich.
Dva priehradky sú pripojené, takže elektródové elektródy toky, kde dochádza k redukcii (katóda), do elektródy, kde dochádza k oxidácii (anóda) (anóda).
Tento prenos elektrónov (alebo prúdu) je však takmer nulové, pretože inak by sa redoxné reakcie vyvinuli, aby sa úplne modifikovali koncentrácie a identity zúčastnených druhov.
Môže vám slúžiť: vodík Bromid (HBR)Namiesto toho voltmeter sotva umožňuje priechod elektrónov, takže existuje stabilné čítanie napätia a že bunka môže dosiahnuť termodynamickú rovnováhu.
Preto sa hovorí, že potenciometria je nerečúcou technikou, pretože málo iónov alebo molekúl sa transformuje do procesu merania, ktorý je tiež reverzibilný.
Hlavné rovnice
Bunkový potenciál
Potenciál bunky súvisí s činnosťami alebo koncentráciami záujmových druhov prostredníctvom Nernstovej rovnice:
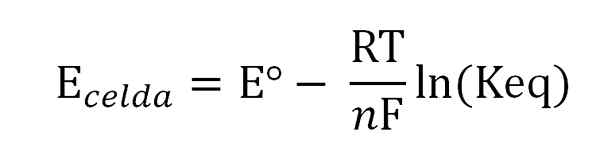 Nernstova rovnica. Zdroj: Gabriel Bolívar.
Nernstova rovnica. Zdroj: Gabriel Bolívar. Kde EST je potenciál tej istej bunky v štandardných podmienkach, F Faraday Constant, n Počet prenesených elektrónov, r konštanta plynu a keqova konštanta globálnej reakcie. Výpočty sa uskutočňujú vymazaním KEQ z čítania ebunka, a výpočet požadovanej koncentrácie vášho expresie rovnováhy.
Je však vhodné vypočítať koncentrácie ľahšou cestou. Na základe dohovoru je potenciál bunky tiež daná nasledujúcou rovnicou:
Abunka = Emriežka- Avôl
Kde emriežka Je to potenciál pre redukciu semi -stredie, kde sa nachádza indikátorová elektróda; zatiaľ čo evôl Je to potenciál pre oxidačné semiflementy, kde máme referenčnú elektródu. Rovnica teda možno prepísať ako:
Abunka = Eukazovateľ - Areferencia + AJ
Byť eJ rovná sa potenciálu spôsobeným kĺbovými kĺbmi mostov. V praxi aJ Nedá sa určiť, ale zabezpečiť, aby jej hodnota bola čo najmenšia pomocou veľmi zriedených riešení alebo zabezpečenie toho, aby boli kompozície v oboch oddeleniach podobné.
Potenciál analytu
Z predchádzajúcej rovnice môžeme vypočítať aukazovateľ, čo je potenciál, ktorý nás skutočne zaujíma. S touto hodnotou znova uplatňujeme Nernstovu rovnicu:
Môže vám slúžiť: acetonitril (C2H3N)Aukazovateľ = E .. - (rt/nf) ln (červená/ox)
Sieť je znížená forma analytu alebo záujmu druhu a OX je jeho oxidovaná forma. Za predpokladu, že analyt je katión Zn2+ Na kovovej zinkovej elektróde by sme mali:
Aukazovateľ = EºZn2+/Zn - (Rt/nf) ln (1/doZn2+)
Kde doZn2+ Je to aktivita katiónov Zn2+, ktoré sú experimentálnymi úpravami celkom blízko jeho koncentrácie, [Zn2+]. Z tejto rovnice je koncentrácia Zn vyčistená2+, že ako je zrejmé, priamo ovplyvňuje hodnotu Eukazovateľ.
Znížená forma zinku, Zn, predstavuje aktivitu rovnajúcu sa 1. Všeobecná rovnica pre hrdzavé katióny kovu, ktorá pôsobí ako elektróda, sa preto bude rovnať:
Aukazovateľ = EºMn+/M - (Rt/nf) ln (1/doM+n)
Ale to platí iba v prípade elektród prvého druhu.
Elektróda
Elektródy sú okrem voltmetra najdôležitejšími prvkami akejkoľvek potenciometrickej analýzy. Niektoré z nich budú uvedené nižšie.
Prvé druhy
Elektródy prvých druhov sú kovy, ktoré oxidujú, aby spôsobili katióny, a vedú elektróny na voltmeter. Niektoré z nich sú nasledujúce: Ag, Zn, Cu, Hg, Sn, TL, CD a BI.
Nie všetky kovy slúžia ako prvé elektródy triedy, pretože by nemali prezentovať kryštalické nepravidelnosti alebo povrchy pokryté oxidovými vrstvami, ktoré spôsobujú nestabilné napätie.
Druhý druh
Na druhej strane elektródy druhých druhov sú tiež kovové, ale na svojom povrchu obsahujú aj soľ, ktorej rozpustnosť závisí od redoxných reakcií, ktoré sa uskutočňujú. Napríklad elektródy AG-AGCL a HG-HG2Cl2 (Calomel), sú elektródy druhých druhov.
Selektívne ióny
Selektívne iónové elektródy, známe tiež ako membrány, sú tie, ktoré sú citlivé na špecifický ión alebo molekulu, ktorá sa prepaľuje cez membránu určenú iba pre neho, aby prešiel a nie na iné druhy v roztoku.
Môže vám slúžiť: obmedzenie a nadmerné činidloObľúbeným príkladom tohto typu elektródy je sklo, postavený na určenie koncentrácie H iónov3Ani+ alebo h+, A tak slúžiť ako pehometer.
Potenciometrické aplikácie
Prostredie
Potentiometria sa používa v environmentálnej chémii pri určovaní CN iónov-, F- a nie3-, ako aj amoniak vo vodných prúdoch.
Klinická chémia
Selektívne elektródy sú veľmi užitočné, keď je meracie médium zložité. Preto budú ostatné ióny alebo molekuly interferovať s hodnotami.
Táto charakteristika je obzvlášť prospešná pri potenciometrických stanoveniach vykonávaných v rovnakých bunkách, kde sa mikroelektródy injikujú na stanovenie koncentrácií K K+, Nat+, Cl-, Ac2+ alebo h+.
Potenciometrické stupne
Predpokladajme, že v strede, kde máme indikátorovú elektródu, je pridaný názov, ktorý reaguje s analytom, a preto modifikuje jeho koncentráciu. Potom dôjde k zmenám v ebunka, čo bude rovnakým spôsobom zodpovedať zmene pH v titrácii kyseliny.
Grafovanie a tedabunka vs. VložkaTitul, Môžeme určiť bod obratu alebo rovnocennosť, as tým budeme poznať koncentráciu analytu.
Potentiometrické stupne sa široko používajú v laboratóriách analytických a fyzikálno -chémie. Niektoré analyty, ktoré možno určiť touto technikou, sú nasledujúce: viera2+, HCO3-, Ac2+, Mg2+, Cu2+, Kyselina askorbová, Haluros, okrem iného.
Všetky stupne do istej miery môžu byť sledované prostredníctvom potenciometrických namiesto toho, aby sa uchýlili k ukazovateľom a ich konečným bodom.
Odkazy
- Deň, r., & Underwood, a. (1986). Kvantitatívna analytická chémia (Piate ED.). Pearson Prentice Hall.
- Džbán.Do., Západný D.M. (1986). Inštrumentálna analýza. (Druhé vydanie.). Medziprítomský., Mexiko.
- DR. Doug Stewart. (2020). Definícia potenciometrie. Získané z: Chemicool.com
- Harvey David. (5. júna 2019). Potntiometrické metódy. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Encyclopaedia Britannica. (2020). Elektrogravimetria. Získané z: Britannica.com
- Wikipedia. (2020). Elektroanalytické metódy. Zdroj: In.Wikipedia.orgán

