Prevádzka elektród Calomel, charakteristiky, použitie

- 1100
- 77
- MUDr. Žigmund Boška
On Elektróda o Calomelanes je sekundárna elektróda, ktorá umožňuje určiť semi -life potenciál vďaka reakcii, ktorá sa vyskytuje medzi ortuťou a chloridom ortuti (i), Hg2Cl2, predtým známy ako Calomel. Oba reagencie, Hg a Hg2Cl2, Vyhrávajú alebo strácajú elektróny v závislosti od média, v ktorom je elektróda ponorená.
Normálne skrátená ako EC, táto elektróda nahrádza mnohými meraniami štandardnej vodíkovej elektródy (ona), pretože je ľahšie ho stavať a menej riskantné manipulovať (napriek ortuti). Vo vnútri obsahuje roztok KCl ako elektrolytické médium pre prietok elektrónov.
 Elektróda Calomel v úplnom meraní. Zdroj: Chandrajit Karmakar, CC BY-SA 4.0, cez Wikimedia Commons
Elektróda Calomel v úplnom meraní. Zdroj: Chandrajit Karmakar, CC BY-SA 4.0, cez Wikimedia Commons Elektróda Calomel môže mať rôzne varianty v závislosti od jej veľkosti alebo dôležitejšej koncentrácie KCL. Keď je roztok KCL nasýtený, hovoríme o elektro zo satuado calomel (ESC). ESC sa ľahšie pripravuje ako EC, ale citlivejšia na zmeny teploty.
Použitie tejto elektródy umožnilo určiť semi -life potenciál pre nespočetné redoxné reakcie. Je to tiež opakujúce sa zariadenie pri potenciometrických stanoveniach, ktoré sa snaží poznať množstvo analytu v závislosti od bunky a meraného potenciálu.
[TOC]
Fungujúci
Takže Calomelova elektróda funguje, pár HG-HG2Cl2 Musíte reagovať, či už víťazstvo alebo stratu elektrónov.
Katódový
Keď sa vo vnútri elektródy Calomel vyskytne redukcia alebo zisk elektrónov, máme nasledujúce reakcie:
Hg2Cl2 → Hg22+ + 2cl- (Ionizácia)
Hg22+ + 2e- → 2hg (redukcia)
Hg2Cl2 + 2e- → 2hg +2cl- (Čistá reakcia)
Môže vám slúžiť: exotermická reakciaPreto HG2Cl2 Vyhrajte elektróny, ktoré sa znižujú na kovovú ortuť.
Potenciál E elektródy, keď dôjde k zníženiu, je daný rovnicou:
E = eº - 0.0591 log [CL-]
Kde sa pozoruje, že závisí výlučne od koncentrácie iónov CL-, ako štandardný redukčný potenciál pre túto nameranú elektródu pred štandardnou vodíkovou elektródou.
Anodický
V rámci elektródy sa môže vyskytnúť aj oxidačný proces:
2HG → Hg22+ + 2e- (Oxidácia)
Hg22+ + 2cl- → Hg2Cl2 (Zrážky)
2hg +2cl- → Hg2Cl2 + 2e- (Čistá reakcia)
To znamená, že ortuť oxiduje, aby vytvorila viac HG2Cl2.
Potenciál E v tomto prípade je uvedený:
E = Eº + 0.0591 log [CL-]
A znova a záleží na [Cl-].
Všeobecná reakcia
Všeobecná reakcia pre Calomelovu elektródu je:
Hg2Cl2(s) + 2e- ⇌ 2hg (l) + 2cl-
Zmysel pre rovnováhu bude závisieť od média, kde je elektróda v kontakte. Cl- Stanovte rozpustnosť HG2Cl2, ktorý má zase vplyv na tvorbu alebo oxidáciu HG.
A potenciál stanovený pre špecifikovanú koncentráciu CL iónov- Bude to rovnaké:
Akalomel = Emriežka - Avôl
Byť ekalomel Potenciál, ktorý sa uvádza ako referencia v určitých potenciálnych tabuľkách.
Charakteristiky elektródy Calomel
Zastúpenie semifinále
Semi -okrajové elektródy Calomel môžu byť reprezentované takto:
PT | Hg | Hg2Cl2| Cl- (Xm)
Kde je dôležitá iba koncentrácia CL iónov-, vyjadrené v molarite alebo normalite. Potenciál E elektródy sa bude meniť, ak je naplnená roztokmi rôznych koncentrácií KCL.
Napríklad EC s KCL 0.1 m má A a rovná sa 0.3356 V pri 25 ° C; Zatiaľ čo ESC, s nasýteným KCL, má jeden a rovný 0.2444 V pri rovnakej teplote.
Môže vám slúžiť: Isopentano: Štruktúra, vlastnosti, použitie, získanieKoncentrácia KCL je preto najdôležitejšou charakteristikou kalomelových elektród, pretože naznačuje, čo sa má použiť, keď sa vykonávajú výpočty potenciometrických meraní.
Komerčne sa dosahujú tri typy kalomelových elektród: nasýtená (ESC), devätnásty (0.1 n alebo 0.1 m kcl) a normálne (1 n alebo 1 m kcl). Elektróda kalomélu 1 M KCl by bola reprezentovaná ako:
PT | Hg | Hg2Cl2| Cl- (1 m)
Večierky
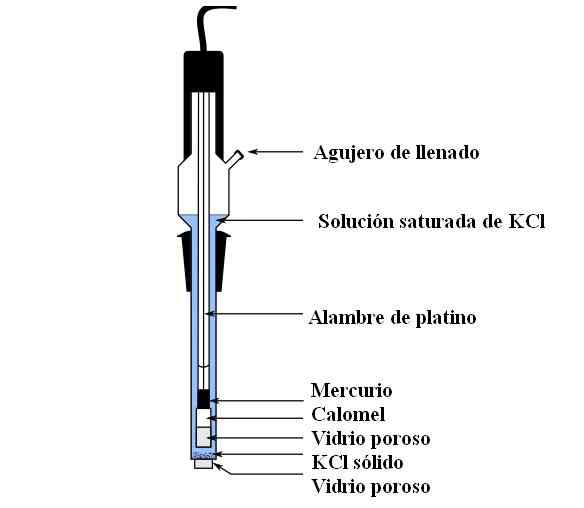 Elektródové diely. Zdroj: Bachi-Bouzou, CC0, cez Wikimedia Commons
Elektródové diely. Zdroj: Bachi-Bouzou, CC0, cez Wikimedia Commons Na hornom obrázku zobrazujeme hlavné časti bežnej kalomelovej elektródy. Je vyrobený zo skla a pozostáva z dvoch kontajnerov: vonkajšieho, ktorý sa vkladá do elektrochemického kontaktu s médom meraní a obsahuje roztok KCL; A vnútorný, kde spočíva zmes HG-HG2Cl2.
Interne obsahuje kalomelová elektróda kvapalnú ortuť, na ktorej sa priľne pasta Hg2Cl2 navlhčené ortuťou. Toto je najaktívnejšia fáza elektródy. Pórovité sklo sa používa na povolenie iba vstupu alebo výstupu CL iónov-, Ale nie kryštály HG2Cl2 alebo ortuť kvapky.
Platinový kábel, v ktorom tok elektrónov, je ponorený do ortuti a je zodpovedný za pripojenie elektródy s voltmeterom a dotknutým vonkajším obvodom.
Prostredníctvom plniaceho otvoru sa naleje roztok KCL, ktorý obsahuje odvrátene rozpustenú soľ. Medzitým v spodnej časti elektródy máme veľmi malý otvor v poréznom skle, ktorý prichádza do priameho kontaktu s médiom meraní. Účelom porézneho skla je povoliť kontakt bez nežiaduce výmeny látok, ktoré kontaminujú elektródu alebo vzorku.
Môže vám slúžiť: cyklohexen: štruktúra, vlastnosti, syntéza a použitiaVýhody
Elektróda Calomel predstavuje nasledujúce výhody vzhľadom na štandardnú vodíkovú elektródu:
-Ľahko sa stava a manipuluje
-Jeho bunkový potenciál zostáva konštantný, aj keď sa voda odparuje
-Nepotrebujete soľný most
ESC je najjednoduchší na stavbu z elektród Calomel, pretože KCL je dosť na rozpustenie, až kým sa nevytvoria ich kryštály. Potom bude roztok nasýtený a pripravený na prelievanie do elektródy.
Nevýhody
Calomelova elektróda však predstavuje tieto nevýhody:
-Tým, že obsahuje tekutá ortuť, môže mať negatívny vplyv na životné prostredie
-Nemôže sa použiť na kvantitatívne analýzy vo vzorkách s teplotou vyššou ako 60 ° C, pretože HG2Cl2 začína sa rozkladá a spôsobuje zlyhanie čítania elektród
ESC má tiež nevýhodu, že je veľmi citlivý na zmeny teploty.
Elektróda striebornej striebornej nahradila kalomel v mnohých potenciometrických stanoveniach.
Žiadosti
Calomelova elektróda je jednou z mnohých elektród, ktoré sa používajú denne pri potenciometrických stanoveniach, ktoré umožňujú získať položivotný potenciál analytov alebo druhov záujmu.
Kalomelová elektróda sa tiež používa pri meraniach pH a cyklickej voltmetrii.
Odkazy
- Deň, r., & Underwood, a. (1986). Kvantitatívna analytická chémia (Piate ED.). Pearson Prentice Hall.
- Wikipedia. (2020). Nasýtená elektróda. Zdroj: In.Wikipedia.orgán
- Všeobecné, eni. (20. októbra 2018). Elektródový kalomel. Chorvátsko-anglický slovník chémie a glosár. Ktf. 30. októbra. 2020. Získané z: Slovník.Perióda.com
- Džbán.Do., Západný D.M. (1986). Inštrumentálna analýza. (Druhé vydanie.). Medziprítomský., Mexiko.
- Kopce, g., Ives, D. Tón. (1950). Kalomelová elektróda. Povaha 165, 530 doi.org/10.1038/165530A0
- Jmgav. (9. decembra 2012). Potenciometria (ii): elektródy. Zdroj: Triplenlace.com
- « Sociálno -kritické paradigmy Charakteristiky, metódy, zástupcovia
- Základy potenciometrie, rovnice, elektródy »

