Štruktúra pyridínu, vlastnosti, použitie, toxicita, syntéza
- 4914
- 781
- Alan Milota
Ten Pyridín Je to aromatický amín, ktorého chemický vzorec je C5H5N. Je to dusíková verzia benzénu, pretože skupina -ch = bola nahradená atómom dusíka (N). Spolu s pyrolom tvorí pyridín skupinu jednoduchších aromatických amínov zo všetkých.
Spočiatku sa pyridín vyskytol z dechtu Hulla, ale bola to malá metóda výkonu. To viedlo k vytvoreniu niekoľkých metód pre jeho chemickú syntézu, ktorá prevládala, v ktorej sa používa reakcia formaldehydu, acetaldehydu a amoniaku.
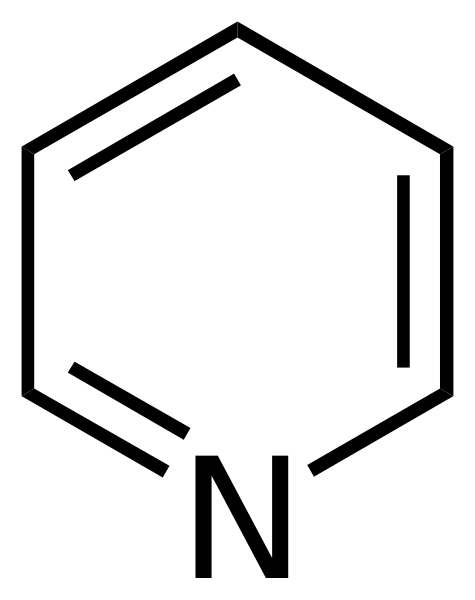 Štrukturálny vzorec pyridínu. Zdroj: Calvero. / Verejná doména
Štrukturálny vzorec pyridínu. Zdroj: Calvero. / Verejná doména Pyridín bol prvýkrát získaný Thomasom Andersonom (1843), chemikmi, ktorí sa vyskytujú, ktorí zahrievaním živočíšneho mäsa a kostí vyrábali olej, z ktorého sa pyridín čistil.
 Thomas Anderson (júl 1819)
Thomas Anderson (júl 1819) Pyridín sa používa ako surovina na syntézu zlúčenín, ktoré eliminujú a kontrolujú proliferáciu hmyzu, húb, bylín atď. Používa sa tiež na vypracovanie mnohých liekov a vitamínov, okrem toho, že sa používa ako rozpúšťadlo.
Pyridín je toxická zlúčenina, ktorá môže chronickým spôsobom poškodiť pečeň, obličky a fungovanie centrálneho nervového systému. Pyridín môže vstúpiť do tela v dôsledku požitia, inhalácie a šírenia pokožkou. Je známy v chemikálii, pretože je to látka schopná spôsobiť bezmocnosť u mužov.
[TOC]
Pyridínová štruktúra
Molekulárny
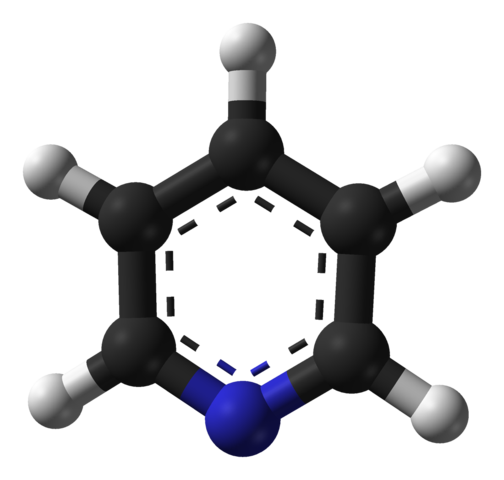 Molekulárna štruktúra pyridínu. Zdroj: Benjah-Bmm27 / verejná doména
Molekulárna štruktúra pyridínu. Zdroj: Benjah-Bmm27 / verejná doména Vynikajúci obraz ukazuje molekulárnu štruktúru pyridínu predstavovanú modelom guľôčok a stĺpcov. Ako je vidieť, jej molekula je veľmi podobná molekule benzénu, s jediným rozdielom, že má jeden z jeho uhlíkov (čierne gule) nahradený dusík (modrá guľa).
Dusík, pretože je viac elektronegatívny, priťahuje k sebe elektronickú hustotu, ktorá vytvára trvalý dipólový moment v pyridíne. Preto pyridínové molekuly interagujú cez dipól-dipolo sily.
Atómy vodíka sú najchudobnejšími oblasťami v elektronoch, takže budú orientované v smere atómu dusíka susednej molekuly.
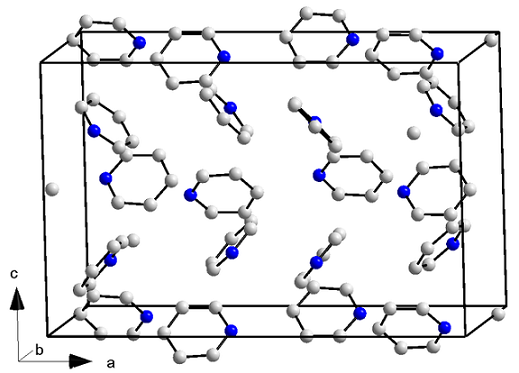
Kryštalický
 Kryštalická štruktúra pyridínu. Zdroj: Orci/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)
Kryštalická štruktúra pyridínu. Zdroj: Orci/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0) Pyridínové molekuly majú nielen dipól-dipolo sily, ale aj s interakciami aromatických krúžkov. Tieto molekuly sa teda dokážu umiestniť v usporiadanom, aby spôsobili kryštál ortorbickej štruktúry (horný obrázok) pri teplote -41,6 ° C.
Pyridínové vlastnosti
 Vzorka pyridínu. LHCHEM/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)
Vzorka pyridínu. LHCHEM/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Fyzický vzhľad
Bezfarebná tekutina s prenikajúcou vôňou, podobná ako pri rybách.
Môže vám slúžiť: Metóda redoxnej rovnováhy: kroky, príklady, cvičeniaMolárna hmota
79,1 g/mol
Hustota
0,9819 g/ml
Bod topenia
-41,6 ° C
Bod varu
115,2 ° C
Rozpustnosť
Je miešateľný s vodou a tiež s alkoholom, éterom, olejom, olejmi a mnohými organickými tekutkami všeobecne.
Tlak vodnej pary
16 mmHg pri 20 ° C.
Hustota
2,72 vo vzťahu k vode = 1
Index lomu (nD)
1 5093
Hrebeň
0,88 cp
Dipolárny moment
2.2 d
zapaľovač
21 ° C
Samostatná teplota
482 ° C
Rozklad
Pri zahrievaní na rozklad emituje kyanidový dym.
Korózia
Pyridín v tekutej forme útočí niektoré formy plastov, kaučukov a povlakov.
pH
8,5 (0,2 m roztok vo vode)
Zásadnosť a reaktivita
Pyridín je slabá základňa. Je to terciárny amín, ktorého 0,2 m roztok vo vode produkuje pH 8,5. Má malú afinitu k elektrónom v dôsledku dusíkovej elektronegativity, takže ich uhlíky zvyčajne netrpia elektrofilnou substitúciou.
Pyridín prežíva nukleofilnú substitúciu, najlepšie v pozíciách C4 a c2 Z prsteňa. Vďaka svojej schopnosti darovať elektróny je pyridín viac oxidácie viac ako benzén a násilne reaguje s kyselinou sírovou, kyselinou dusičnou a anhydridom maleico.
Použitie pyridínu
Pesticídy
Pyridín je predchodca herbicídov Forequat a Diquat. Rovnakým spôsobom slúži na syntézu insekticídu chlórifos, ktorého počiatočným krokom je chlorácia pyridínu. Je to tiež počiatočná surovina na získanie fungicídu založeného na pyritácii.
Solventný
Pyridín je polárne rozpúšťadlo, ktoré sa používa na reakcie predajcu a extrakciu antibiotík. Pyridín sa používa ako rozpúšťadlo v priemysle farieb a gumárov a tiež vo výskumných laboratóriách ako rozpúšťadlo pri extrakcii rastlinných hormónov.
Liek
Pyridín slúži ako počiatočný bod v syntéze cetilpyridínium a lauilpyridínium, zlúčeniny, ktoré sa používajú ako antiseptiká v produktoch orálnej a zubnej starostlivosti. Molekula pyridínu je súčasťou chemickej štruktúry mnohých liekov.
Napríklad esmeprazol, ktorý sa používa pri liečbe gastroezofágového refluxu. Loratidín je ďalší liek pripravený na pyridíne, známy ako claritín, ktorý sa používa ako liečba alergických procesov.
Tablety pyridínu (fenazopyridínu) sa používajú pri symptomatickej liečbe podráždenia močových ciest, ktoré sa v niektorých prípadoch sprevádza, bolesť, pálenie a naliehavosť močenia. Fenazopyridín je farbivo, ktoré plní analgetickú funkciu v močových traktoch.
Di-acylhidrazín je derivát pyridínu, ktorý má antibakteriálnu aktivitu, ktorá vyvíja gramne negatívne baktérie, ako napríklad A. coli, a gram pozitívne baktérie, ako napríklad Siež. Albus.
Pyridín slúži ako základ pre tiazolo [5,4-6] pyridínu, zložený z antivírusovej aktivity, najmä proti vírusu pm-hmoty chrípky chrípky. 2-acetylpyridín, derivát pyridínu, má veľkú protinádorovú aktivitu a je inhibítorom leukémie.
Môže vám slúžiť: oxid ortuti (HG2O)Ďalší
Pyridín sa používa pri výrobe vitamínov, gumových výrobkov, lepidiel, obrazov a insekticídov. Používa sa tiež pri denaturácii alkoholu a pri farbení niektorých textílií.
20 % pyridínu sa používa pri príprave piperidínu. Piperidín zasahuje do vulkanizácie a poľnohospodárstva.
Pyridín sa tiež používa pri syntéze polykarbonovaných živíc, ako príchuť potravín a ako činidlo na detekciu kyanidu.
Toxicita
- Pyridín vstupuje do organizmu hlavne v dôsledku inhalácie a difúzie pokožkou. Akútna expozícia pyridínu môže spôsobiť podráždenie a popáleniny v očiach a koži.
- Pyridín môže v pokožke pochádzať z dermatitídy a alergie. Vývoj alergie môže byť sprevádzaný okrem svrbenia a vyrážky.
- Vdýchnutie pyridínu môže spôsobiť podráždenie nosa a krku sprevádzané kašľaním a astmatickým dýchaním dychu.
- Požitím môže pyridín spôsobiť nevoľnosť, zvracanie, hnačku a bolesť brucha. Podobne môže byť začlenenie vysokej dávky pyridínu do organizmu spôsobené: bolesť hlavy, únava, vyblednutie, ohromujúce, závraty, zmätok a nakoniec jesť a smrť a smrť.
- Orgány najviac postihnuté pôsobením pyridínu sú pečeň, obličky, mužské pohlavné orgány a centrálny nervový systém. Môže tiež pôsobiť na kostnú drene, ktorá vyvoláva produkciu krvných doštičiek. Karcinogénny účinok pyridínu nebol preukázaný u zvierat.
OSHA vytvorila expozíciu vo vzduchu 5 ppm za 8 -hodinový pracovný deň.
Syntéza
Prvé metódy získania pyridínu boli založené na jeho extrakcii organických materiálov. Thomas Anderson (1843) získal prvýkrát pyridín zahrievaním mäsa a živočíšnych kostí. V prvej fáze Anderson vyrobil olej, z ktorého sa mu podarilo destilovať pyridín.
Tradične sa pyridín získal z splyňovania dechtu Hulla alebo uhlia. Tieto postupy boli ťažkopádne a málo výkonu, pretože koncentrácia pyridínu v týchto surovinách bola veľmi nízka. Bola potrebná metóda syntézy.
Chichibabin
Aj keď existuje veľa metód na syntézu pyridínu, postup chichibabínu zavedený v roku 1923 sa stále používa hlavne. V tejto metóde je pyridín syntetizovaný z reakcie formaldehydu, acetaldehydu a amoniaku, ktoré sú lacnými činidlami.
Môže vám slúžiť: typ odkazu 02V prvej fáze reagujú formaldehyd a acetaldehyd za vzniku akroolínovej zlúčeniny v kondenzačnej reakcii Knoevegel, ktorá tiež tvorí vodu.
 Kondenzácia pyridínu z Acroleína a acetaldehydu
Kondenzácia pyridínu z Acroleína a acetaldehydu Nakoniec v druhej fáze Acroleína reaguje s formaldehydom a amoniakom za vzniku dihydropyridínu. Následne sa dihydropyridín oxiduje na pyridín v reakcii pri 350 -550 ° C v prítomnosti tuhého katalyzátora, napríklad kremičitý -haleňa.
Reakcie
Elektrofylické substitúcie
Tieto substitúcie sa zvyčajne nevyskytujú v dôsledku nízkej elektronickej hustoty pyridínu.
Sulfanácia predstavuje väčšie ťažkosti ako nitrácia. Ale bromácia a chlorácia sa vyskytujú ľahšie.
Pyridín-n-oxid
Oxidačné miesto v pyridíne je atóm dusíka, ktorý je oxidáciou produkovanou broskyňami (kyseliny, ktoré majú skupinu OOH). Oxidácia dusíka podporuje elektrofilnú substitúciu v uhlíkoch 2 a 4 pyridínu.
Nukleofilné substitúcie
Pyridín môže zažiť niekoľko nukleofilných substitúcií v dôsledku nízkej elektronickej hustoty uhlíkov pyridínového kruhu. Tieto substitúcie sa vyskytujú ľahšie v pyridínovej molekule modifikovanej kyselinou bromínom, chlórom, fluórom alebo kyselinou sulfónovou.
Zlúčeniny vykonávané nukleofilnými útokmi na pyridín sú zvyčajne: alcoxidy, tyoláty, amíny a amoniak.
Rybárske reakcie
Pyridín sa môže diemrovať radikálnymi reakciami. Radikálna pyridínová dimerizácia sa vykonáva s elementárnym sodíkom alebo niklom raney, ktorá je schopná produkovať 4,4'-bipperidín alebo 2,2'-bipperidín.
Reakcia na atóm dusíka
Kyseliny sa podľa Lewisa ľahko pridávajú do atómu dusíka pyridínu, ktoré tvoria pyridínové soli. Pyridín je Lewisova základňa, ktorá daruje niekoľko elektrónov.
Hydrogenácia a redukčná reakcia
Piperidín sa produkuje hydrogenáciou pyridínu s niklom, kobaltom alebo ruténiom. Táto reakcia sa uskutočňuje pri vysokých teplotách sprevádzaných použitím katalyzátora.
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10th Vydanie.). Wiley Plus.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Morrison a Boyd. (1987). Organická chémia. (Piate vydanie). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Pyridín. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2020). Pyridín. Databáza pubchem., CID = 1049. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Laura Foist. (2020). Pyridín: Štruktúra, vzorec a fyzikálne vlastnosti. Štúdium. Získané z: štúdie.com
- Atof Ali Altaf, Adnan Shahzad, Zarif Gul, Nasir Rasool, Amin Badshah, Bhajan Lal, Ezzat Khan. (2015). Preskúmanie liečivého významu pyridínových derivátov. Journal of Drug Design and Liečna chémia. Zvuk. 1, nie. 1, pp. 1-11. Doi: 10.11648/j.Jddmc.20150101.jedenásť
- Webmd. (2020). Pyridínový tablet. Zdroj: WebMD.com
- Ministerstvo zdravotníctva v New Jersey a služby seniorov. (2002). Pyridín. [PDF]. Získané z: NJ.Vláda
- « C ++ História, charakteristiky, typy údajov, príklady
- Funkcie esenciálnych mastných kyselín, dôležitosť, nomenklatúra, príklady »

