Štruktúra pepsinogénu, funkcie, typy, syntéza
- 1398
- 96
- Blažej Hrmo
On Pepsinogén Je to zimogén pepsínu, jeden z hlavných hydrolytických enzýmov zodpovedných za vykonávanie trávenia proteínov v žalúdku cicavcov. Zimogény alebo proenzýmy sú neaktívne enzymatické prekurzory, to znamená, že nie sú schopné katalyzovať reakcie vykonávané ich aktívnymi formami.
Jeho aktivácia závisí od zmien v trojrozmernej štruktúre proteínu, ktoré vedú k tvorbe funkčného aktívneho miesta. Tieto zmeny sa vo väčšine prípadov zhodujú s proteolytickým prasknutím proteínového segmentu.
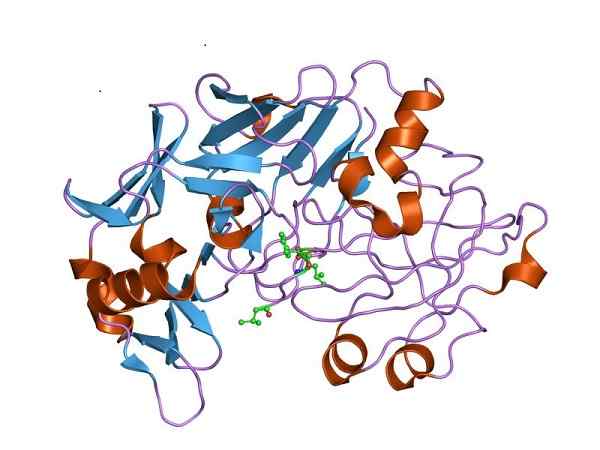
 Tri -dimenzionálna štruktúra pepsínu, katalyticky aktívna forma pepsinogénu. Autor: Jawahar Swaminathan a personál MSD v Európskom bioinformatickom inštitúte [verejná doména (https: // creativecommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons
Tri -dimenzionálna štruktúra pepsínu, katalyticky aktívna forma pepsinogénu. Autor: Jawahar Swaminathan a personál MSD v Európskom bioinformatickom inštitúte [verejná doména (https: // creativecommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons Preto musí pepsinogén pociťovať štrukturálne zmeny, aby získal požadovanú aktivitu peptidázy a uprednostňoval trávenie proteínov v žalúdku, po príjme potravy.
[TOC]
Štruktúra
Pepsinogén je 371 aminokyselinový proteín patriaci k veľkej rodine aspartických proteináz, ktorý sa vyznačuje prezentovaním zvyškov kyseliny aspartárovej v aktívnom centre.
Jeho kvartérna štruktúra bola stanovená prvýkrát pre proteín exprimovaný v ošípaných prostredníctvom techniky kryštalografie X -Ray. Výsledok bol podobný výsledku vykazovaným zrelou alebo aktívnou formou proteínu, Pepsin.
Zistený jediný rozdiel je teda prítomnosť v pepsinogéne 44 aminokyselinového peptidu, ktorý sa zloží cez rozštiepenie aktívneho miesta. V tejto polohe bráni interakcii tejto proteázy s proteínmi, ktoré sa majú degradovať.
Tento peptid, ktorý sa bude kvitnúť, aby vznikol aktívny enzým, sa nachádza na amino terminálnom konci proteínu.
Pretože funguje iba ako čiapka, neschopnosť degradického proteínu pepsinogénu nie je spôsobená štrukturálnymi deformáciami aktívneho centra. Naopak, to zostáva s rovnakou konformáciou v oboch formách enzýmu.
Môže vám slúžiť: glukány: štruktúra, charakteristiky a funkcieV tomto zmysle je potrebné poznamenať, že kryštálová štruktúra pepsinogénu predstavuje približný model štruktúry iných zimogenov patriacich k veľkej rodine aspartických proteínov.
Funkcia
Na začiatku života je pepsín (aktívna forma pepsinogénu) dôležitá pre trávenie mlieka. Následne je jeho funkciou degradovať proteíny diéty vo svojich zložkách (aminokyseliny), aby sa uľahčila ich ľahká absorpcia.
Syntéza a sekrécia
Pepsinogén je syntetizovaný hlavnými bunkami a fundickými bunkami žalúdočnej sliznice. Následne sa ukladá v sekrečných vezikulách, ktoré zostávajú v cytoplazme týchto buniek až do okamihu, keď je potrebné ich uvoľňovanie.
Preto je sekrécia tohto zimogénu regulovaný proces. Jeho uvoľňovanie vezikúl, obyvateľov cytosolu prostredníctvom exocytózy, vyžaduje hormonálne a nervové stimuly. Zvýšenie hladín žalúdočných enzýmov vylučuje a gastrín, ako aj acetylcholínu, cholecystoystochinín, epidermálny rastový faktor a oxid dusnatého stimulujú ich syntézu a sekréciu.
Experimenty uskutočňované s bunkami ATT20, bunkovej línie bežne používanej pri štúdiu vylučovacích ciest u cicavcov, ukázali, že zvýšenie cyklického AMP je tiež schopné takúto sekréciu vyvolať takúto sekréciu.
Okrem normálnej sekrécie na úrovni žalúdka sa detegovalo relatívne nízke množstvo pepsinogénu v krvi aj v moči, a preto sa nazýva uropepsinogén.
Pôvod uropepsinogénu, ako aj funkcia, ktorú môže vykonávať na obidvoch miestach, zostáva bez toho, aby sa určil. Zdá sa však, že ich neprítomnosť u pacientov, ktorí úplne odstránili žalúdok, naznačuje, že ich pôvod je rovnako žalúdok.
Chlapci
Doteraz boli opísané dva hlavné typy pepsinogénu: Pepsinogén I a Pepsinogén II. Oba typy nepredstavujú rozdiely v ich katalytickej aktivite a sú rovnako aktivované proteolytickou hydrolýzou v závislosti od kyseliny chlorovodíkovej.
Môže vám slúžiť: denaturácia proteínov: čo je, faktory, dôsledkyPepsinogén I je syntetizovaný a segregovaný tak hlavnými bunkami, ako aj fondikálnymi bunkami žalúdočnej sliznice. Preto sa jej sekrécia znižuje u pacientov s atrofickou chronickou gastritídou, ochorením žalúdka charakterizované celkovým zmiznutím žalúdočných žliaz.
Na rozdiel od toho je Pepsinogén II (PGII) syntetizovaný prakticky všetkými bunkami, ktoré sú súčasťou žalúdočnej sliznice, ale výraznejšie tie z antrálnej sliznice a bunky, ktoré tvoria Brünnerové žľazy prítomné v dvanástniku.
U pacientov s atrofickou chronickou gastritídou tento typ pepsinogénu kompenzuje zníženie sekrécie pepsinogénu I.
Existencia týchto dvoch typov pepsinogénu, ktoré sa líšia iba tým, že ich vylučuje rôzne bunky, sa môže zdať redundantná. Môže to však byť evolučná adaptácia, ktorá zaručuje syntézu pepsínu, kedykoľvek je to potrebné.
Aktivácia
Pepsinogén získava katalytickú aktivitu, keď sa transformuje na pepsín, produkt eliminácie 44 aminokyselinového peptidu prítomného v dutine aktívneho miesta.
Jeho optimálna prevádzka závisí od nízkych hodnôt pH zahrnutých v rozsahu 1,5 až 2. Vo fyziologických podmienkach sa tieto hodnoty udržiavajú sekréciou kyseliny chlorovodíkovej v intracelulárnych kanáloch.
Trávenie kyseliny na úrovni žalúdka sa neuskutočňuje u všetkých zvierat, čo je príkladom, je hmyz, ktorým chýba pepsinogén. Avšak stavovce, ktoré majú žalúdok, ak majú peptickú aktivitu.
Pepsinogén, ktorý je uložený v sekrečných vezikulách hlavných buniek, sa v prípade potreby uvoľňuje do žalúdočného kanálika. Akonáhle dosiahne žalúdok, stáva sa pepsínom produktom kyslého prostredia a tieto aktívne pepsinogénnejšie molekuly.
Pôsobením vnútorných nervových vlákien a vagálnej vonkajšej stimulácie je stimulovaná produkcia pepsinogénu, ako aj HCL, gastrín a histamín. Na druhej strane histamín a gastrín stimulujú parietálne bunky na vylučovanie HCL.
Môže vám slúžiť: vodivé tkaniny: Čo je, charakteristiky, funkciePepsín, rovnako ako všetky endopeptidázy, pôsobí na špecifické väzby medzi proteínovými aminokyselinami na generovanie menších peptidov.
Inými slovami; Hydrolyzuje vnútorné peptidové väzby proteínu. Jeho účinok je účinnejší v peptidových väzbách blízko aromatických aminokyselín (fenylalanín, tyrozín). Na rozdiel od svojho prekurzora Zimogen, adaptívne zmeny pepsínu v hodnotách pH väčšie ako 6 spôsobujú ireverzibilné pokles katalytickej aktivity.
Odkazy
- Bryksa BC, Tanaka T, Yada RY. N-terminálna modifikácia Zvyšuje stabilitu pepsínu neutrálnym ph. Biochémia. 2003; 42: 13331-13338.
- Foltmann B, Pedreson VB. Porovnanie primárnych štruktúr kyslej proteszie a ich zymogénov. Adv Exp Med Biol. 1977; 95: 3-22.
- Guyton A, Hall J. (2006). Učebnica lekárskej fisiológie. (11. vydanie.). USA: Elsevier Saunders.
- Kasper D, Fauci A, Longo D, Braunwald E, Hauser S, Jameson J. (2005). Harrison, princípy vnútornej medicíny. (16. vydanie.). Mexiko: McGrawhill.
- Kitahara F, Shimazaki R, Sato T, Kojima Y, Morozumi A, Fujino MA. Ťažká atrofická gastritída s infekciou Helicobacter pylori a rakovinou žalúdka. Rakovina žalúdka. 1998; 1: 118-124.
- Lin Y, Find M, Lin X, Harttsuck JA, Tang J. Závislosť pH kinetických parametrov pepsínu, rhizopuspepsínu a ich mutantov vodíkových väzieb aktívneho miesta. J Biol Chem. 1992; 267: 18413-18418.
- Mangeat p. Sekrécia kyseliny a reorganizácia membrány v jednotlivých žalúdočných parietálnych bunkách v primárnej kultúre. Biológia. 1990; 69: 223-257.
- Prozialeck J, Wershil BK. (2017). Vývoj žalúdočnej sekrečnej funkcie. Fetálna a novorodenecká fyziológia (piate vydanie). Zväzok 1, strany 881-888.
- Schubert Ml. Žalúdočné tajomstvo. Súčasný opin gastroent 2005; 21: 633-757.
- Sielecki AR, Fedorov AA, Boodhoo A, Andreeva NS, James MNG. Molekulárne a kryštálové štruktúry monoklinického ošípaného pepsínu rafinované pri 1.Rozlíšenie 8 Á. J Mol Biol. 1990; 214: 143-170.
- Webb PM, Hengels KJ, Moller H, Newell DG, Palli D, Elder JB. Epidemiológia hladín s nízkym obsahom pepsinogénu v sére a medzinárodnej súvislosti s mierou rakoviny žalúdka. Gastroenterológia. 1994; 107: 1335-1344.
- Wolfe MM, Soll AH. Fyziológia tajomstva žalúdočnej kyseliny. N English J Med 1998; 319: 1707.
- « Vývoj G buniek, gastrín, rašelinové skľučujúce kanály
- Charakteristiky Nanche, biotop, vlastnosti, recepty na varenie »

