Molekulárna kyslíková štruktúra, vlastnosti, používa
- 4922
- 271
- Valentín Dula
On Molekulárny kyslík ani Dioxygén, Tiež sa nazýva diatomický alebo plynný kyslík, je to najbežnejšia elementárna forma, v ktorej sa tento prvok nachádza na planéte Zem. Jeho vzorec je alebo2, Preto je diatomická a homonukleárna molekula, úplne apolar.
Vzduch, ktorý dýchame, sa skladá z asi 21% kyslíka ako molekúl alebo2. Čím viac vystúpime, koncentrácie plynného kyslíka sa znižujú a zvyšujú prítomnosť ozónu, alebo3. Naše telo využíva O2 Na okysličenie vaše tkanivá a vykonávanie bunkového dýchania.
 Bez obohatenia kyslíka by náš život atmosféry bol neudržateľným javom. Zdroj: Pixabay.
Bez obohatenia kyslíka by náš život atmosféry bol neudržateľným javom. Zdroj: Pixabay. O2 Je tiež zodpovedný za existenciu ohňa: bez neho by bolo takmer nemožné mať požiare a spaľovanie. Je to preto, že jej hlavnou vlastnosťou má byť výkonným oxidačným činidlom, vyhrať elektróny alebo redukovať molekulu vody alebo v oxidových aniónoch alebo2-.
Molekulárny kyslík je nevyhnutný pre nespočetné aeróbne procesy, ktoré majú aplikácie v metalurgii, medicíne a čistení odpadových vôd. Tento plyn je prakticky synonymom tepla, dýchania, oxidácie a na druhej strane mrazených teplôt, keď má vo svojom kvapalnom stave.
[TOC]
Molekulárna kyslíková štruktúra
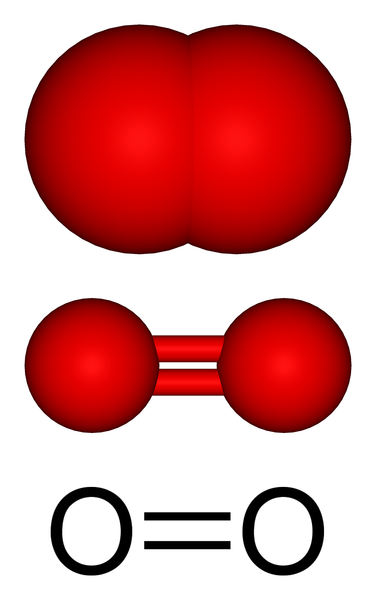
 Plynná molekulárna štruktúra kyslíka. Zdroj: Benjah-Bmm27 Via Wikipedia.
Plynná molekulárna štruktúra kyslíka. Zdroj: Benjah-Bmm27 Via Wikipedia. Na hornom obrázku máme molekulárnu štruktúru plynného kyslíka reprezentovanú pomocou niekoľkých modelov. V posledných dvoch charakteristikách kovalentnej väzby, ktorá udržuje atómy kyslíka.
Môže vám slúžiť: DiastreoméryMolekula alebo2 Je lineárny, homonukleárny a symetrický. Jeho dvojitá väzba má dĺžku 121 hod. Táto krátka vzdialenosť robí určitú značnú energiu potrebnú (498 kJ/mol) na prelomenie spojenia o = o, a preto je relatívne stabilná molekula.
Ak áno, kyslík atmosféry by sa v priebehu času úplne zhoršil, alebo by sa vzduch zapálil na nič.
Vlastnosti
Fyzický vzhľad
Molekulárny kyslík je bezfarebný, bez chuti a bez zápachu, ale pri kondenzácii a kryštalizácii nadobudne moderné tóny.
Molárna hmota
32 g/mol (zaoblená hodnota)
Bod topenia
-218 ° C
Bod varu
-183
Rozpustnosť
Molekulárny kyslík nie je príliš rozpustný vo vode, ale dosť na podporu morskej fauny. Keby bola vaša rozpustnosť väčšia, bolo by menej pravdepodobné, že zomrie na utopenie. Na druhej strane, jeho rozpustnosť je oveľa väčšia v olejoch a apolárnych kvapalinách, je schopná ich pomaly oxidovať, a tak ovplyvniť ich pôvodné vlastnosti.
Energetické štáty
Molekulárny kyslík je látka, ktorú nemožno úplne opísať teóriou Valencia Link (TEV).
Elektronická konfigurácia kyslíka je nasledovná:
[On] 2s² 2p⁴
Má pár chýbajúcich elektrónov (alebo :). Keď sa nájdu dva atómy kyslíka, sú spojené s vytvorením dvojitej väzby O = o, dokončujú obidva oktet Valencia.
Preto molekula alebo2 Mal by byť diamagnetický, so všetkými jeho párovanými elektrónmi. Je to však paramagnetická molekula, ktorá je vysvetlená diagramom jeho molekulárnych orbitálov:
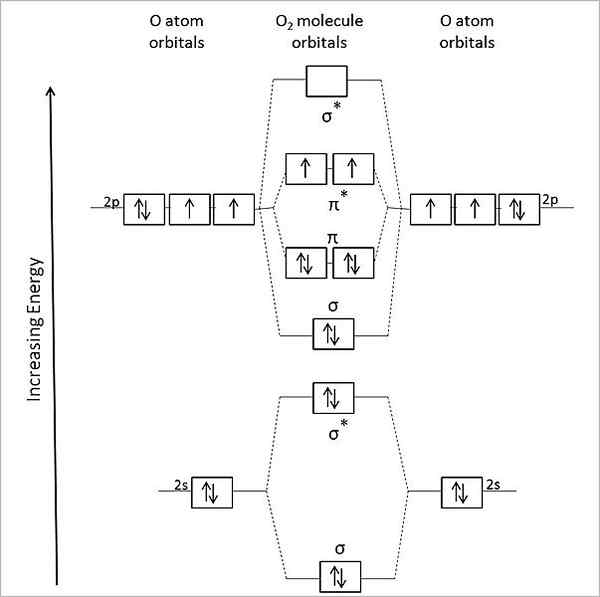 Molekulárny orbitálny diagram pre plynový kyslík. Zdroj: Anthony.Sebastian/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)
Molekulárny orbitálny diagram pre plynový kyslík. Zdroj: Anthony.Sebastian/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Molekulárna orbitálna teória (Tom) teda lepšie opisuje alebo2. Dva chýbajúce elektróny sú umiestnené na molekulárnych orbitáloch π*, väčšej energie a dávajte kyslík s paramagnetickým charakterom.
Môže vám slúžiť: metylamín: štruktúra, vlastnosti, výroba, použitieV skutočnosti tento energetický stav zodpovedá kyslíku Triplet, 3Ani2, Najdôležitejší zo všetkých. Ďalší energetický stav kyslíka, menej hojný na Zemi, je jediný, 1Ani2.
Transformácia
Molekulárny kyslík je značne stabilný, pokiaľ nie je v kontakte s látkou, ktorá je náchylná na oxidovanie, oveľa menej, ak neexistuje blízky zdroj intenzívneho tepla, ako je iskra. Je to preto, že o2 Má vysokú tendenciu znižovať, získavať elektróny z iných atómov alebo molekúl.
Po znížení je schopný vytvoriť široké spektrum prepojení a tvarov. Ak tvorí kovalentné väzby, urobí to s menšími elektronegatívnymi atómami ako on, vrátane vodíka, aby vzniesol vodu, H-O-H. Môže to byť tiež uhlíkový vesmír, spôsobiť väzby C-O a niekoľko typov okysličených organických molekúl (éteres, ketóny, aldehydy atď.).
O2 Môžete tiež získať elektróny na transformáciu peroxidov a superoxidov, alebo22- I2-, respektíve. Keď sa v organizme stáva peroxidom, získanie peroxidu vodíka sa získa, h2Ani2, H-O-O-H, škodlivá zlúčenina, ktorá je spracovaná pôsobením špecifických enzýmov (peroxidázy a katalasy).
Na druhej strane a v neposlednom rade O2 reaguje s anorganickou hmotou, aby sa stala oxidovým aniónom, alebo2-, Zostavovanie nekonečného zoznamu mineralogických hmôt, ktoré napučiavajú kôru a pozemný plášť.
Žiadosti
Zvary
 Kyslík sa používa na spaľovanie acetylénu a na vystrelenie plameňa intenzívneho tepla, ktorý je cenný vo zvaroch. Zdroj: Sheila/CC od (https: // creativeCommons.Org/licencie/BY/2.0)
Kyslík sa používa na spaľovanie acetylénu a na vystrelenie plameňa intenzívneho tepla, ktorý je cenný vo zvaroch. Zdroj: Sheila/CC od (https: // creativeCommons.Org/licencie/BY/2.0) Kyslík sa používa na vykonanie spaľovacej reakcie, pomocou ktorej sa látka exotermicky rozkladá oheň. Tento oheň a jeho teplota sa líšia v závislosti od látky, ktorá spaľuje. Tak je možné získať veľmi horúce plamene, ako je acetylén (vyššie).
Môže vám slúžiť: EnthalpiaAk nie pre kyslík, palivá nemohli horieť a poskytovať všetku svoju kalorickú energiu, používané na odstránenie rakiet alebo na založenie automobilov.
Oxidačné činidlo v zelenej chémii
Vďaka tomuto plynu sa syntetizujú alebo priemyselne vyrábajú nekonečné organické a anorganické oxidy. Tieto reakcie sú založené na oxidačnej sile molekulárneho kyslíka, ktorý je tiež jedným z naj životasriesnejších činidiel zelenej chémie na získanie farmaceutických výrobkov.
Asistované dýchanie a čistenie odpadových vôd
Kyslík je nevyhnutný na uspokojenie dopytu dýchacích ciest u pacientov s vážnymi zdravotnými stavmi, v potápačoch, keď zostupujú v nízkych hĺbkach a u horolezcov, v ktorých nadmorská výška koncentrácie kyslíka vyzerá dramaticky znížená.
Podobne kyslík „kŕmi“ aeróbne baktérie, ktoré pomáhajú degradovať kontamináciu odpadu z odpadovej vody alebo pomáha dýchať ryby, vo vodných plodinách na ochranu alebo obchodu.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Alotropy kyslíka. Zdroj: In.Wikipedia.orgán
- Hone, c.Do., Kappe, C.Ani. (2019). Použitie molekulárneho kyslíka na aeróbne oxidácie kvapalnej fázy v nepretržitom prietoku. Top Cur Chem (Z)377, 2. doi.org/10.1007/S41061-018-0226-Z
- Kevin Beck. (28. januára 2020). 10 použití pre kyslík. Obnovené z: vedeckých.com
- Útes. (2020). Biochémia I: Chémia molekulárneho kyslíka. Získané z: Cliffsnotes.com
- Priemyselné zásoby GZ. (2020). Priemyselné prínosy kyslíka plynu. Zdroj: GZ-Supplies.com
- « Kultúra portugalských tradícií, zvykov, gastronómie, náboženstva
- Deštruktívna interferenčná vzorec a rovnice, príklady, cvičenie »

