Degenerované orbitály

- 4169
- 809
- Valentín Dula
 Energetická schéma s orbitálmi obsadenými chýbajúcimi elektrónmi. Zdroj: Gabriel Bolívar
Energetická schéma s orbitálmi obsadenými chýbajúcimi elektrónmi. Zdroj: Gabriel Bolívar Ten Degenerované orbitály Sú to tí, ktorí sa nachádzajú na rovnakej úrovni energie. Podľa tejto definície musia mať rovnaké hlavné kvantové číslo n. Preto sú orbitály 2S a 2p degenerované, pretože patria do energetickej úrovne 2, hoci je známe, že ich funkcie uhlových a radiálnych vĺn sú rôzne.
Ako hodnoty n, Elektróny začínajú zaberať ďalšie energetické podskupiny, ako sú orbitály D a F.
Každá z týchto orbitálov má svoje vlastné charakteristiky, ktoré sa na prvý pohľad pozorujú vo svojich uhlových formách; Sú to sférické čísla (stopy), činky (P), ďatelových listov (D) a guľového (F).
Medzi nimi je rozdiel v energii, dokonca aj patriaci k rovnakej úrovni n.
Napríklad energetická schéma s orbitálmi obsadenými chýbajúcimi elektrónmi (abnormálny prípad) je uvedená v hornom obrázku (abnormálny prípad).
Je zrejmé, že zo všetkých, najstabilnejšou (najmenej energiou) je orbitál NS (1s, 2s, ...), zatiaľ čo NF je najstabilnejší (ten s najväčšou energiou).
Degenerované orbitály izolovaného atómu
Degenerované orbitály s rovnakou hodnotou ako n, Sú v rovnakej línii v energetickej schéme.
Z tohto dôvodu sú tri červené pruhy, ktoré symbolizujú orbitály P, umiestnené v rovnakej línii; Rovnako ako fialové a žlté pruhy.
Obrazová schéma porušuje pravidlo umývadla: Orbitály väčšej energie sú naplnené elektrónmi.
Môže vám slúžiť: kyseliny a základy: rozdiely, charakteristiky, príkladyKeď sa elektróny naviažu, orbitál stráca energiu a vyvíja väčšie elektrostatické odpudenie na chýbajúcich elektrónoch ostatných orbitálov.
Takéto účinky sa však v mnohých energetických diagramoch nezohľadňujú. Ak áno a poslúchajú pravidlo umývadla bez úplného vyplnenia orbitálov D, bolo by zrejmé, že prestanú degenerovať.
Ako je uvedené vyššie, každý orbitál má svoje vlastné vlastnosti. Izolovaný atóm s elektronickou konfiguráciou je ochotný jeho elektróny v presnom počte orbitálov, ktoré im umožňujú hostiť ich.
Iba tí, ktorí sú energiou, sa môžu považovať za degenerované.
Orbitáli P
Tri červené pruhy pre orbitály obrázka obrázka naznačujú, že obidva PX, pa A pz Majú rovnakú energiu.
V každom z nich je elektrón, opísaný štyrmi kvantovými číslami (n, l, ml a pani), zatiaľ čo prvé tri popisujú orbitály.
Jediný rozdiel medzi nimi je označený magnetickým momentom ml, ktorá čerpá trajektóriu PX Na osi x, pa na osi y a Pz na osi Z.
Tri sú rovnaké, ale líšia sa iba vo svojej priestorovej orientácii. Z tohto dôvodu sú vždy nakreslené energiou, to znamená degenerovať.
Rovnako ako, inomotívny atóm dusíka (s konfiguráciou 1S22s22 P3) Musíte mať svoje tri orbitály degenerované. Energetický scenár sa však náhle mení, ak sa považuje za atóm n v rámci chemickej molekuly alebo zlúčeniny.
Je to tak preto, že hoci PX, pa A pz Sú rovnaké v energii, to sa môže meniť v každom z nich, ak majú rôzne chemické prostredie; to znamená, že ak sú spojené s rôznymi atómami.
Môže vám slúžiť: Isopreno: Štruktúra, vlastnosti, aplikácieOrbitály D
Päť fialových pruhov označuje orbitály D. V izolovanom atóme, aj keď majú spárované elektróny, sa domnievajú, že týchto päť orbitálov je degenerovaných. Na rozdiel od orbitálov však tentoraz existuje výrazný rozdiel v ich uhlových formách.
Preto ich elektróny cestujú smery do priestoru, ktoré sa líšia od jedného orbitálneho d do druhého.
To spôsobuje, podľa Teória kryštalického poľa, že minimálne narušenie spôsobuje a rozvíjajúce sa energie orbitálov; To znamená, že päť fialových pruhov oddeľuje energetickú medzeru medzi nimi:
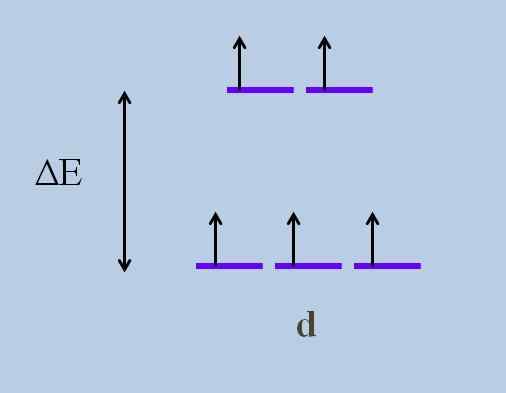 Schéma orbitálov vyvíjajúca energiu. Zdroj: Gabriel Bolívar
Schéma orbitálov vyvíjajúca energiu. Zdroj: Gabriel Bolívar Aké sú orbitály vyššie a ktoré sú nižšie? Vyššie sú symbolizované ako ag, A tie nižšie tón2 g.
Všimnite si, ako boli pôvodne všetky fialové pruhy zarovnané a teraz sa vytvorila sada dvoch orbitálov ag viac energie ako druhá sada troch orbitálov tón2 g.
Táto teória umožňuje vysvetliť prechody D-D, ktorým sú udelené mnoho farieb pozorovaných v zlúčeninách prechodných kovov (CR, MN, viera atď.).
Toto elektronické narušenie je spôsobené koordinačnými interakciami kovového centra s inými molekulami nazývanými Ligandy.
Orbitáli f
A s orbitálmi f, siedmimi žltými pruhmi, je situácia ďalej komplikovaná. Jeho priestorové adresy sa medzi nimi veľmi líšia a vizualizácia ich prepojení sa stáva príliš zložitou.
V skutočnosti sa predpokladá, že orbitály f majú takú vnútornú vrstvu, že sa „nezúčastňujú“ na tvorbe prepojení.
Môže vám slúžiť: oxid z postupe (CL2O7)Ak je atóm izolovaný orbitálmi F obklopený inými atómami, začínajú interakcie a rozvíjanie sa vyskytuje (strata degenerácie):
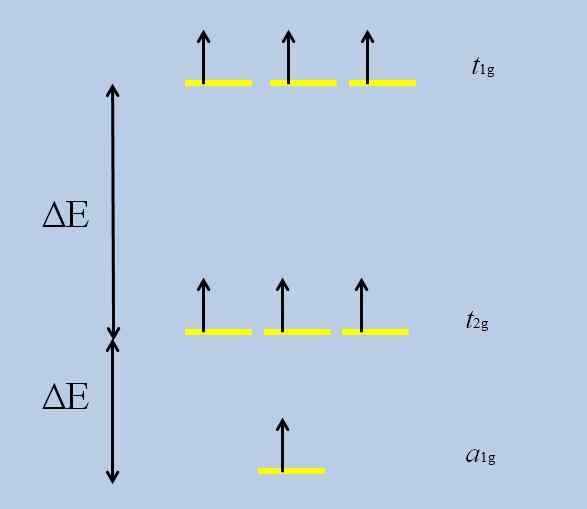 Schéma straty degenerácie. Zdroj: Gabriel Bolívar
Schéma straty degenerácie. Zdroj: Gabriel Bolívar Všimnite si, že žlté pruhy teraz tvoria tri sady: tón1g, tón2 g a do1g, A už nie sú degenerovaní.
Degenerované hybridné orbitály
Bolo zrejmé, že orbitáli sa môžu rozvíjať a strácať degeneráciu. Aj keď to vysvetľuje elektronické prechody, nevysvetľuje to, ako a prečo existujú rôzne molekulárne geometrie. Tu vstupujú hybridné orbitály.
Jeho hlavnou charakteristikou je, že sú degenerované. Vznikajú teda zo zmesi orbitálnych znakov s, p, d a f, aby spôsobili degenerované hybridy.
Napríklad tri p orbitály sú zmiešané s jedným s, aby sa dali štyri orbitály SP3. Všetky spritálie SP3 Sú degenerované, a preto majú rovnakú energiu.
Ak sú navyše zmiešané dve orbitály so štyrmi SP3, Získa sa šesť orbitálov3d2.
A ako vysvetľujú molekulárne geometrie? Keďže existuje šesť, s rovnakými energiami, musia sa následne viesť symetricky v priestore, aby sa vytvorili rovnaké chemické prostredie (napríklad v MF zlúčenine6).
Keď áno, vytvorí sa oktadron koordinácie, čo sa rovná oktaedrickej geometrie okolo centra (M).
Geometrie však zvyčajne predstavujú skreslenia, čo znamená, že ani hybridné orbitály nie sú úplne degenerované.
Preto ako záver, degenerované orbitály existujú iba v izolovaných atómoch alebo vysoko symetrických prostrediach.
Odkazy
- Definícia degerácie. Získané z: Chemicool.com
- Atómy a atómové orbitály. Zotavené z iskry.com
- Whitten, Davis, Peck & Stanley. Chémia. (8.ª Ed.). Učenie sa.

