Štruktúra nitrobenzénu (C6H5NO2), vlastnosti, použitia, riziká

- 4761
- 1091
- Blažej Hrmo
On nitrobenzén Je to aromatická organická zlúčenina tvorená benzénnym kruhom C6H5- A skupina nitro -no2. Jeho chemický vzorec je C6H5Nie2. Je to farebná alebo bledo žltá mastná tekutina, s vôňou horkých mandlí alebo topánok pre topánky.
Nitobenzén je veľmi užitočná zlúčenina v chemickom priemysle, pretože umožňuje získať sériu chemických látok, ktoré majú rôzne použitie. Je to preto, že môže byť predmetom rôznych typov reakcií.
 Nitrobencene, c6H5-Nie2. Autor: Marilú Stea.
Nitrobencene, c6H5-Nie2. Autor: Marilú Stea. Medzi dôležité chemické reakcie patrí nitrácia (ktorá vám umožňuje pridať ďalšie skupiny -nie2 do molekuly) a redukcia (opak oxidácie, keď sú eliminované dva atómy kyslíka nitro -no2 a sú nahradené hydrogénmi).
S nitrobencenom môžete pripraviť napríklad anilín a para-acetaminofenol. Posledne menovaný je dobre známy acetaminofén, ktorý je antipyretický (liek horúčky) a mäkký analgetikum (liečivo s menšou bolesťou).
Nitobenzén sa musí manipulovať opatrne, pretože je dráždivý a toxický, môže spôsobiť druh anémie medzi niekoľkými príznakmi a verí sa, že môže spôsobiť rakovinu. Je to tiež škodlivé pre životné prostredie.
[TOC]
Štruktúra
Nitrobenzén C6H5-Nie2 Je to plochá molekula tvorená benzénom kruhu C6H5- na ktorú je skupina nitro prepojená -nie2. Jeho molekula je plochá, pretože existuje elektronická interakcia medzi skupinou nitro -no2 a benzénový prsteň.
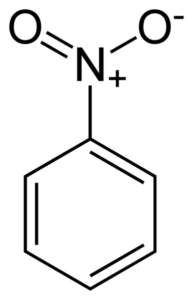 Plochá štruktúra molekuly nitrobenzénu. Elektróny dvojitých bondyanových kruhových odkazov majú tendenciu interagovať so skupinou nitro -no2. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons.
Plochá štruktúra molekuly nitrobenzénu. Elektróny dvojitých bondyanových kruhových odkazov majú tendenciu interagovať so skupinou nitro -no2. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons. Skupina nitro -no2 má tendenciu priťahovať elektróny benzénneho kruhu C6H5-.
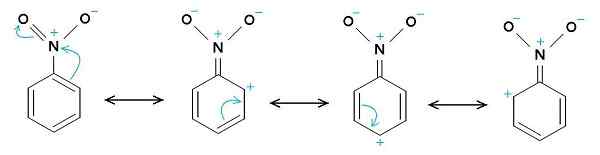 Rezonančné štruktúry nitrobenzénu. Benzénový krúžok má tendenciu mať kladné zaťaženie, zatiaľ čo skupina nitro -no2 má tendenciu mať záporné zaťaženie. Pôvodný nováčik bol Samuele Madini v talianskej Wikipédii. [Verejná doména]. Zdroj: Wikimedia Commons.
Rezonančné štruktúry nitrobenzénu. Benzénový krúžok má tendenciu mať kladné zaťaženie, zatiaľ čo skupina nitro -no2 má tendenciu mať záporné zaťaženie. Pôvodný nováčik bol Samuele Madini v talianskej Wikipédii. [Verejná doména]. Zdroj: Wikimedia Commons. Preto má molekula o niečo negatívnejšiu stránku (kde je kyslík -no2) a o niečo pozitívnejšia stránka (benzénový krúžok).
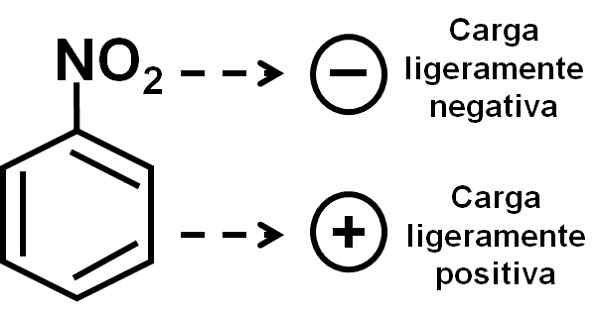 Kyslík zo skupiny nitro má mierne negatívne zaťaženie v porovnaní s benzénnym kruhom. Autor: Marilú Stea.
Kyslík zo skupiny nitro má mierne negatívne zaťaženie v porovnaní s benzénnym kruhom. Autor: Marilú Stea. Menovanie
- Nitrobenzén.
- Nitrobenze.
- Nitrobenzol.
- Ropa alebo podstata Mirbano alebo Mirbana (nepoužívaný termín).
Vlastnosti
Fyzický stav
Farebná mastná tekutina až bledožltá.
Molekulová hmotnosť
123,11 g/mol.
Bod topenia
5,7 ° C.
Bod varu
211 ° C.
Môže vám slúžiť: chlorid kobaltu (COCL2 (: štruktúra, nomenklatúra, vlastnostiBod vzplanutia
88 ° C (metóda zatvoreného pohára).
Teplota
480 ° C.
Hustota
1 2037 g/cm3 pri 20 ° C.
Rozpustnosť
Little Water Rozpustný: 0,19 g/100 g vody pri 20 ° C. Úplne miešateľný s alkoholom, benzénom a dityl éter.
Chemické vlastnosti
Nitrobencén je stabilný až do teploty približne 450 ° C, pri ktorej sa začína rozkladať tvorba (v neprítomnosti kyslíka)2, benzén, bifenyl, anilín, dibenzofurano a naftalén.
Medzi dôležité reakcie nitrobencenu patrí redukcia, dusičnany, halogenácia a sulfonácia.
Nitrácia nitrobenzénu spočiatku produkuje meta-nitrobenzén a s dlhou reakciou sa získa 1,3,5-nitobenzén.
Reakcia brómu alebo chlóru s nitrobenzénom v prítomnosti vhodného katalyzátora sa získa 3-bróm-nitrobenzén (meta-bromonitrobencen) alebo 3-cllo-nitrobenzén (meta-chlóritrobenzén).
Príkladom redukcie je, že pri riešení Tin (SN) v kyseline chlorovodíkovej (HCl) sa meta-halogenonitobenzény získavajú meta-halogenoanylínmi.
Sulfonácia nitrobenzénu sa uskutočňuje s kyselinou fajčiarskou kyselinou sulfurou pri 70-80 ° C a produktom je meta-nitrobenzeulfonický meta-nitrobenze. To sa dá znížiť pomocou železa a HCl, čím sa poskytne kyselina metanyl.
Stmievanie
V roztoku benzénu c6H6 Molekuly nitrobenccénu sú spojené so sebou navzájom tvoriacimi priemermi alebo pármi molekúl. V týchto pároch je jedna z molekúl v obrátenej polohe vzhľadom na druhú.
Tvorba priemerov nitrobenzénu s molekulami jedna v obrátenej polohe vzhľadom na druhú je pravdepodobne spôsobená skutočnosťou, že každý z nich má o niečo pozitívnejšiu stranu a opačnú stranu s mierne záporným zaťažením.
V diméri je strana s mierne kladnejším zaťažením jednej z molekúl pravdepodobne umiestnená blízko mierne negatívneho zaťaženia inej molekuly, pretože je priťahované opačné zaťaženie, a tak sa stáva s ostatnými dvoma stranami.
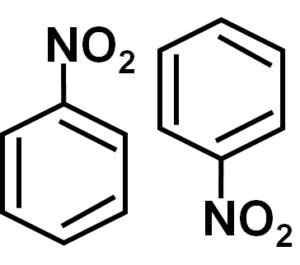 Číslo nitrobencenu, to znamená dve molekuly, ktoré majú tendenciu byť spolu v niektorých rozpúšťadlách. Autor: Marilú Stea.
Číslo nitrobencenu, to znamená dve molekuly, ktoré majú tendenciu byť spolu v niektorých rozpúšťadlách. Autor: Marilú Stea. Ďalšie vlastnosti
Predstavuje zápach podobnú mandľám alebo leštiaci pre topánky. Znížením svojej stuhnutia teploty vo forme zelenkavých žltých kryštálov.
Získanie
Dostanete liečbu benzénu C6H6 So zmesou kyseliny dusičnej HNO3 a kyselina sírová H2SW4. Tento proces sa nazýva nitrácia a zahŕňa tvorbu iónu nitín2+ Vďaka prítomnosti kyseliny sírovej H2SW4.
- Nitronio Ion Nie2+:
Hned3 + 2 h2SW4 ⇔ h3Ani+ + 2 HSO4- + Nie2+ (Nitronio ión)
- Nitronio ión útočí na benzén:
Môže vám slúžiť: systematická chyba: Ako ju vypočítať, vo fyzike, príklady, príkladyC6H6 + Nie2+ → C6H6Nie2+
- Vytvára sa nitrobencene:
C6H6Nie2+ + HSO4- → C6H5Nie2 + H2SW4
Súhrn:
C6H6 + Hned3 → C6H5Nie2 + H2Ani
Benzénová nitátna reakcia je veľmi exotermická, to znamená, že sa generuje veľmi teplo, takže je veľmi nebezpečná.
Žiadosti
Pri získavaní anilínu a acetaminofénu
Nitrobencen sa používa hlavne na syntézu anilínu C6H5NH2, čo je široko používaná zlúčenina na prípravu pesticídov, ďasien, farbív, výbušnín a liekov.
Získanie anilínu sa vyskytuje znížením nitrobenzénu v kyslom médiu v prítomnosti železa alebo cínu, ktorý sa vykonáva podľa nasledujúcich krokov:
Nitrobenzén → nitrosobenzén → fenylhydroxylamín → anilín
C6H5Nie2 → C6H5Nie → C6H5NHOH → C6H5NH2
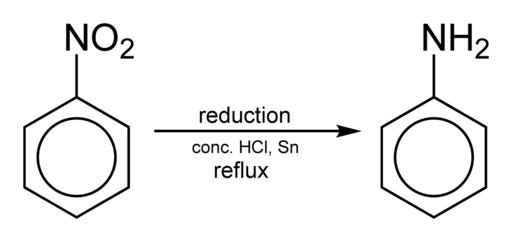 Redukcia nitrobencenu na získanie anilínu. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Redukcia nitrobencenu na získanie anilínu. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. V závislosti od podmienok sa proces môže zastaviť v jednom zo stredných krokov, napríklad vo fenylhydroxylamíne. Počnúc fenylhydroxylamínom v silne kyslom prostredí je možné pripraviť para-aminofenol:
Fenylhdroxylamín → p-Aminofenol
C6H5NHOH → HOC6H4NH2
Posledne menovaný je ošetrený octickým anhydridom, aby sa získal paracetamol (acetaminofén) jemný antipyretický a mäkký analgetikum, to znamená liek na liečbu horúčky a bolesti a bolesti.
 Niekedy je možné liečiť s acetaminofénom deťom s horúčkou. Acetaminofén je derivát nitrobenzénu. Autor: Augusto Ordonez. Zdroj: Pixabay.
Niekedy je možné liečiť s acetaminofénom deťom s horúčkou. Acetaminofén je derivát nitrobenzénu. Autor: Augusto Ordonez. Zdroj: Pixabay.  Acetaminofénové tabletky, derivát nitrobenzénu. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe z Ottawy, Canadaderivative Work: Anrie [CC By (https: // creativecommons.Org/licencie/o/3.0)]. Zdroj: Wikimedia Commons.
Acetaminofénové tabletky, derivát nitrobenzénu. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe z Ottawy, Canadaderivative Work: Anrie [CC By (https: // creativecommons.Org/licencie/o/3.0)]. Zdroj: Wikimedia Commons. Ďalším spôsobom, ako získať anilín, je zníženie nitrobenzénu oxidom uhoľnatým (CO) vo vodnom médiu v prítomnosti veľmi malých častíc (nanočastice) paladium (PD) ako katalyzátora ako katalyzátora.
C6H5-Nie2 + 3 co + h2O → C6H5-NH2 + 3 co2
Pri získavaní ďalších chemických zlúčenín
Nitobenzén je východiskovým bodom na získanie širokej škály použitých zlúčenín, ako sú farbivá, pesticídy, lieky a kozmetika.
 Niektoré farbivá sa získavajú vďaka nitrobenzénu. Autor: Edith Lüthi. Zdroj: Pixabay.
Niektoré farbivá sa získavajú vďaka nitrobenzénu. Autor: Edith Lüthi. Zdroj: Pixabay. Napríklad umožňuje získať 1,3-dinitrobencén, že chloráciou (pridaním chlóru) a redukciou (eliminácia atómov kyslíka) vytvára 3-chlóranylin. Používa sa ako sprostredkovateľ pre pesticídy, farbivá a lieky.
Nitobenzén sa použil na prípravu benchidínu, ktorý je farbivo. Okrem toho nitrobenzén slúži na prípravu chinolínu, azobenzénu, kyseliny metanylovej, dyitobenzénu, izocianátu alebo pyroxilínu medzi mnohými ďalšími zlúčeninami.
V niekoľkých aplikáciách
Nitobenzén sa používa alebo používa ako:
Môže vám slúžiť: nenasýtené uhľovodíky- Extrakčné rozpúšťadlo na čistenie mazacích olejov používaných v strojových zariadeniach
- Rozpúšťadlo pre celulózové étery
- Zmes ingrediencie do poľských kovov
- V mydlách
- V zmesiach pre poľské topánky
- Konzervátor striekacieho farby
- Zložka leštiaceho podlahy
- Nahradenie mandľovej esencie
- V parfumovom priemysle
- Pri výrobe syntetického gumy
- Rozpúšťadlo v rôznych procesoch
 Nitobenzén je súčasťou niektorých zmesí leštiacej obuvi. D-Kuru [CC BY-SA 3.0 at (https: // creativeCommons.Org/licencie/By-SA/3.0/at/skutok.in)]. Zdroj: Wikimedia Commons.
Nitobenzén je súčasťou niektorých zmesí leštiacej obuvi. D-Kuru [CC BY-SA 3.0 at (https: // creativeCommons.Org/licencie/By-SA/3.0/at/skutok.in)]. Zdroj: Wikimedia Commons. Riziká
Nitobenzén je toxický inhaláciou, požitím a absorpciou pokožkou.
Dráždi pokožku, oči a dýchací trakt. Môže spôsobiť typ anémie nazývanej methemoglobinémia, ktorá spočíva v znižovaní schopnosti červených krviniek uvoľňovať kyslík v tkanivách a vytvára únavu.
Nitrobencene okrem toho spôsobuje dýchavičnosť, závraty, rozrušené videnie, nedostatok dychu, kolaps a smrť. Tiež poškodzuje pečeň, slezinu, obličky a centrálny nervový systém.
Odhaduje sa, že to môže byť mutagén a pravdepodobne spôsobuje rakovinu ľudí, pretože ju spôsobil u zvierat.
Nitrobencene by sa navyše nemalo vyradiť v životnom prostredí. Jeho toxicita voči zvieratám, rastlinám a mikroorganizmom je veľmi škodlivá pre ekosystémy.
Toxicita smerom k mikroorganizmom znižuje jeho biologicky odbúrateľnosť.
Liečba jeho odstránenia životného prostredia
Znečistenie životného prostredia s nitrobencenami sa môže vyskytnúť prostredníctvom plytvania rôznymi odvetviami, ktoré ho používajú, napríklad sfarbenie alebo priemysel výbušnín.
Nitobenzén je vysoko toxický a ťažko sa rozpadá v prírodných podmienkach, z tohto dôvodu môže spôsobiť závažnú kontamináciu pitnej farby a siatie zavlažovacích systémov.
Vďaka svojej vysokej stabilite a toxicite voči mikroorganizmom sa často vyberá ako model v štúdiách úpravy odpadových vôd.
Skúmajú sa rôzne spôsoby, aby sa eliminovali kontaminovanú vodu nitrobenzén. Jedným z nich je fotokatalytická degradácia, tj, použitie slnečného žiarenia ako urýchľovača degradačnej reakcie v prítomnosti oxidu titánu titánu2.
 Pri slnečnom reaktore je možné odstrániť znečistenie vody nitrobencenom. Mihai-cosmin Pascariu [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Pri slnečnom reaktore je možné odstrániť znečistenie vody nitrobencenom. Mihai-cosmin Pascariu [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Metódy mikroelektrolýzy boli tiež úspešne testované pomocou železného katalyzátora (viery) a meďou (Cu) v keramike. Mikroelektrolýza umožňuje nitrobenzénu rozkladať sa cez elektrický prúd.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Nitrobenzén. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Morrison, r.Tón. a Boyd, r.N. (2002). Organická chémia. 6. vydanie. Hara.
- Moldinganu, s.C. (2019). Pyrolýza iných zlúčenín dusíka. V pyrolýze organických molekúl (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Smith, P.W.G. a kol. (1969). Aromatické dusičnany-nitro zlúčeniny. Elektrofilné substitúcie. V aromatickej chémii. Zotavené z vedeckých pracovníkov.com.
- Windholz, m. a kol. (redaktori) (1983). Index Merck. Enyklopedia chemikálií, liekov a biologických. Desiate vydanie. Merck & Co., Inc.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. Zväzok A22. VCH Verlagsgellschaft MBH.
- Whang, T.-J. a kol. (2012). Fotokatalytická degradácia nitrobenzénu Iradovaná UV väzbou na kremennú trubicu. International Journal of PhotoEnergy, Zväzok 2012, ID článkov 681941. Hyndawi sa zotavil.com.
- Shikata, T. a kol. (2014). Tvorba nitrobenzénu anti-paralelné diméry v nepolárnych rozpúšťadlách. AIP Advances 4, 067130 (2014). Zotavené z Doaj.orgán.
- Krogul-obczak, a. a kol. (2019). Redukcia nitrobenzénu na anilín pomocou CO/H2Alebo v svedectve nanočastíc paládium. Katalyzátory 2019, 9, 404. MDPI sa zotavila.com.
- Jang, b. a kol. (2019). Výroba pilotného meradla, vlastnosti a aplikácia Fe/Cu Catalytic-Ceramic Filler na čistenie odpadových vôd nitrobenzénu. Katalyzátory 2019, 9, 11. MDPI sa zotavila.com.
- « Vzorec mechanickej výhody, rovnice, výpočet a príklady
- 110 večných frázy pre priateľov a manželov »

