Vlastnosti dusitanov, štruktúra, nomenklatúra, školenie
- 2985
- 104
- Ing. Ervín Petruška
Ten dusity Sú to všetky tie zlúčeniny, ktoré obsahujú anión2-, Ak sú anorganické alebo skupiny -ono, ak sú organické. Prevažná väčšina sú kovové dusičnany, ktoré sú anorganické soli, kde nie2- Elektrostaticky interagovať s katiónmin+; Napríklad katión sodný, NA+.
Teda dusitan sodný, nano2, Je to príklad soli alebo dusitanovej zlúčeniny. Tieto soli sa nachádzajú v povahe, buď v pôdach, moriach, cicavcoch a rastlinných tkanivách, pretože sú súčasťou biologického cyklu dusíka. Preto nie2- Je to látka prítomná v našich organizmoch a je spojená s vazodilatátorovými procesmi.
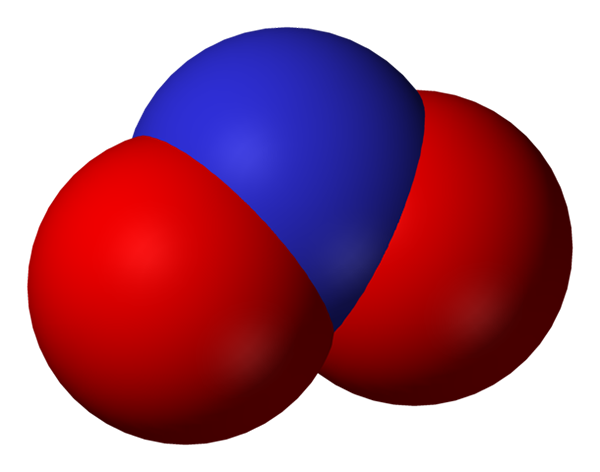
 Priestor plný dusitanového aniónu. Zdroj: Benjah-Bmm27.
Priestor plný dusitanového aniónu. Zdroj: Benjah-Bmm27. Dusitan sa stáva menšou formou dusíka alebo menej oxidovaného ako dusičnan, nie3-. Oxid dusnatého sa z neho vyskytuje, nie v oblastiach organizmu, kde je nedostatok kyslíka. Nie je to signalizačná molekula, ktorá vyvíja vazodilatátorový efekt uvoľnením svalov a tepien.
Z biochémie a medicíny sa dusitany používajú ako baktericídy, čo je ich agregácia na celkom bežné mäso. To s cieľom ich vyliečiť a rozšíriť ich kvalitu a čerstvosť dlhšie.
Dusičnan má dve tváre: jedna prospešná pre zdravie a druhá, ktorá ho ohrozuje. Dobrá tvár je presne spôsobená reakciami, ktoré ju znižujú na nie. Medzitým je zlá tvár spôsobená jej transformáciou na nitrozamín: rodina organických zlúčenín, ktoré majú niekoľko členov, ktorí boli uznaní ako karcinogénne látky.
[TOC]
Dusity
Základnosť
Dusity sú základné soli, pretože anión nie2- Je to konjugovaná základňa kyseliny dusnej, HNO2:
Hned2 + H2Alebo ⇌ nie2- + H3Ani+
Vo vode av niekoľkých množstvách sa hydrolyzuje, aby vznikol OH ióny-:
Nie2- + H2Alebo hno2 + Oh-
Táto základnosť je vnútorná pre všetky dusičské soli, pretože závisí od nie2- a nie z katiónov, ktoré ho sprevádzajú. Tieto katióny a ich interakcie s NO2- Ovplyvňujú rozpustnosť dusitanových solí vo vode a iných polárnych rozpúšťadlách.
Reakcie
Reakcie dusitanov sa líšia v závislosti od toho, ktoré katióny sprevádzajú NO2-, alebo či ide o organický dusitan, Rono. Všeobecne povedané, dusitany sa môžu rozkladať, oxidovať alebo redukovať na: oxidy kovov, nie3-, Nie2, Nie a dokonca plyn dusíka, n2.
Môže vám slúžiť: termodynamické procesyNapríklad dusitan amónny, NH4Nie2 sa môže rozložiť na n2 a h2Ani.
Fyzický vzhľad
Takmer všetky dusitany sú tuhé látky kryštalického vzhľadu. Mnohé z nich sú belavé alebo žltkasté farby, aj keď sú farebné, ak obsahujú katióny s prechodnými kovmi.
Na druhej strane sú väčšinou organické dusitany vysoko nestabilné a výbušné prchavé kvapaliny.
Štruktúra
Anión dusičnanu
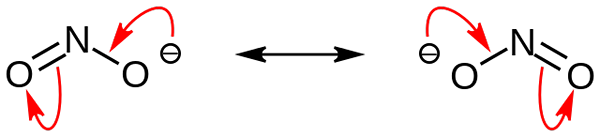 Štruktúry rezonancie dusitanového aniónu. Zdroj: Doména nohingserius / krčma
Štruktúry rezonancie dusitanového aniónu. Zdroj: Doména nohingserius / krčma Na prvom obrázku bol znázornený anión dusitanu s modelom s plným priestorom. Tento model má nevýhodu, ktorá je úplne rovnaká ako v prípade oxidu dusičného, nie2. Na druhej strane, vynikajúci obraz popisuje lepšie dusitanový anión a ako sa správa jeho negatívne zaťaženie.
Toto zaťaženie sa premiestni medzi dvoma atómami kyslíka, takže každý z nich má polovicu uvedeného záporného zaťaženia (-1/2). A je to negatívne bremeno zodpovedné za prilákanie okolitých katiónov v dôsledku jednoduchej elektrostatickej príťažlivosti.
Tuhá látka
Anorganické dusitany sú všetky kryštalické tuhé zlúčeniny. Jeho interakcie sú čisto elektrostatické a majú príťažlivosť medzi no2- a katióny mn+. Napríklad nano2 Má ortomrombickú kryštalickú štruktúru a je tvorená na ióny+ a nie2-.
Typ kryštalickej štruktúry bude závisieť od identity m+n, Takže nie všetky dusity zdieľajú orcombickú štruktúru.
Organické dusitany
Organické dusitany, na rozdiel od anorganických, nie sú iónové zlúčeniny, ale kovalentné. Preto sú tvorené z molekúl, ktoré sa vyznačujú tým, že majú R-Aon Link, kde r môže byť alkylová alebo aromatická skupina.
Považujú sa za estery kyseliny dusnej, pretože ich vodík, H-Don, je nahradený skupinou R:
 Všeobecný vzorec pre organický dusitan. Zdroj: pngbot cez Wikipedia.
Všeobecný vzorec pre organický dusitan. Zdroj: pngbot cez Wikipedia. Podľa vynikajúceho obrazu by tento ester mohol byť napísaný ako rum = o, veľmi podobný vzorcu uhlíkových esterov, ROC = o. Všimnite si veľkú podobnosť, ktorú má táto štruktúra s štruktúrou nitro zlúčenín, RNO2, kde teraz hlavným odkazom je R-NO2 A nie R-Dono. Jediný rozdiel spočíva preto v atóme, s ktorým sa spája2 do skupiny r.
Z tohto dôvodu sa estery dusitanov a nitro zlúčeniny považujú.
Komplex
Komplexy dusitanov môžu mať anorganické aj organické komponenty. Tvoria koordinačné spojenie medzi kovovým centrom a jedným z kyslíka bez kyslíka2-. To znamená, že sa nehovorí o čisto elektrostatickej interakcii, mn+Nie2-, ale koordinácie mn+-ALEBO NIE-.
Môže vám slúžiť: Aké sú fyzické vlastnosti hmoty?Organické dusitany a ich komplexy vytvoria alebo nie sú kryštalické štruktúry v závislosti od toho, či ich interakcie dokážu nastaviť svoje častice do vesmíru.
Menovanie
Anorganické a organické dusitany zdieľajú značne jednoduchú nomenklatúru. Aby som ich pomenoval, slová „Nitrite of“, po ktorom nasleduje meno kovu a jeho valencia napísaná v zátvorkách. Podobne aj zakončenie -Co a -So v prípade, že je možné použiť viac ako jeden Valencia.
Napríklad Cuno2 Môže byť pomenovaný dvoma spôsobmi: medený dusitan (i) alebo dusitanový dusitan.
Toto pravidlo nomenklatúry sa vzťahuje aj na organické dusitany. Napríklad Cho3Ono sa nazýva mettilo nitrito, pretože ch3 zodpovedá skupine R spojenou s no kyslíkom2.
Nomenklatúra môže byť komplikovaná, ak existujú aj iné skupiny rovnakého alebo väčšieho chemického významu ako NO2, alebo ak sú to kovové komplexy.
Výcvik
Zverenie
Mnoho anorganických dusitanov sa vytvára v povahe v jednom z krokov dusíkového cyklu: nitrifikácia. Tento proces pozostáva z oxidácie amoniaku vykonávaných mikroorganizmami, konkrétne, baktériami Nitrosomonas.
Nitrifikácia tiež pokrýva následnú oxidáciu dusičnanu na dusičnan; Tvorba dusitanu je však pomalý krok týchto reakcií, pretože vyžaduje väčšiu energiu a musí prekonať väčšiu kinetickú bariéru.
Nasledujúca rovnica je príkladom novo exponovaného:
2nh4+ + Tretí2 → 2NO2- + 4H+ + 2h2Ani
Túto reakciu sa zúčastňuje niekoľko enzýmov a vyrába sa hydroxylamín, NH2Och, čo je produkt, z ktorého budú konečne vzniknúť anióny dusitanov.
Vďaka nitrifikácii rastliny obsahujú dusitany a zvieratá, ktoré ich konzumujú. Dusičnany sú nielen prítomné v pôde, ale aj v moriach a takmer všetka ich prirodzená produkcia je spôsobená oxidačným a anaeróbnym pôsobením rôznych mikroorganizmov.
Oxidy dusíka v základných médiách
Nitrity alkalických kovov sa môžu pripraviť priemyselne bubinovaním oxidov dusíka v základných roztokoch alebo médiách, buď z ich príslušných hydroxidov alebo uhličitanov. Napríklad dusitan sodný sa vyskytuje podľa nasledujúcej reakcie:
Nie +nie2 + NaOH → 2Nano2 + H2Ani
V prípade dusitanu amónneho sa v amoniaku bublovuje oxid dyitrogénu:
Môže vám slúžiť: Rodio: História, vlastnosti, štruktúra, použitie, riziko2nh3 + H2Alebo +n2Ani3 → 2nh4Nie2
Reakcia s oxidom dusnatého
Alquilico dusitany, rono, sa dajú syntetizovať pomocou reakcie. Všeobecná reakcia by bola nasledujúca:
R-OH → R-AON
Nitrites
Vytvrdzovanie mäsa
 Červenkastá farba mäsa je spôsobená jeho liekom s dusičnanmi a dusičnanmi. Zdroj: pxhere.
Červenkastá farba mäsa je spôsobená jeho liekom s dusičnanmi a dusičnanmi. Zdroj: pxhere. Dusičnany majú antibakteriálne účinky, takže sa pridávajú v miernom množstve do mäsa, aby spomalili svoju hnilobu. Okrem plnenia tejto funkcie reagujú s mäsovými proteínmi, aby im poskytovali červenkastejšie a atraktívnejšie sfarbenie.
Zlá stránka tejto praxe je, že niektoré mäso môžu mať príliš veľa dusitanových solí a pri ich varení pri vysokých teplotách sa transformujú na nitrosoaminas. Preto existuje riziko zvýšenia šancí na kontrahovanie určitého druhu rakoviny, ak je konzumácia týchto vyliečených mäsov nadmerná.
Farbivá
Dusičnany sa používajú v organickej chémii na vykonávanie diazotálnej reakcie, s ktorou sa sfarbenie alebo farbivo syntetizuje.
Pigmenty
Niektoré dusitanové komplexy, ako je kobalt, sa môžu použiť ako pigmenty pre maľby alebo porcelán kvôli ich nápadným sfarbeniam.
Vazodilatátor
Nitrity sú zodpovedné za vytváranie oxidu dusnatého v tele v deficitných kyslíkových oblastiach. Nie je to signalizačná molekula, ktorá reaguje na relaxačné a rozširujúce sa krvné cievy. Táto expanzia alebo dilatácia má v dôsledku toho, že krvný tlak klesá.
Príklady dusitanov
Nakoniec, niektoré príklady dusičnanov budú uvedené s ich príslušnými vzorcami a menámi:
-Starší brat2: dusitan sodný
-Pokaziť sa2: dusík draselný
-Mg (nie2)2: Dusitan horčík
-Výtok2)2: dusitan vápenatý
-Chvály3Chvály2Ono: etyldetrit
-NH4Nie2: dusitan amónny
-Zn (nie2)2: Zinok dusita
-PB (nie2)2: Olovo dusitan (II) alebo inštalatérsky dusitan
-Viera (nie2)3: Železný dusitan (III) alebo železitý dusitan
-(Ch3)2Štiepka2Chvály2Ono: Isoamilo Nitrito
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10. vydanie.). Wiley Plus.
- Wikipedia. (2020). Dusitan. Zdroj: In.Wikipedia.orgán
- Elsevier B.Vložka. (2020). Dusitan. Vedecký. Zdroj: ScienceDirect.com
- Alfa Aesar. (2020). Dusitanové soli. Themo Fisher Scientific. Získané z: Alfa.com
- Redaktori Enyclopaedia Britannica. (23. februára 2018). Dusity. Encyclopædia Britannica. Získané z: Britannica.com
- Anthony R. Butler a Martin Feelisch. (22. apríla 2018). Terapeutické použitie anorganického dusitanu a dusičnanu. doi.org/10.1161/CirculationAHA.107.753814
- Kris Gunnars. (10. februára 2020). Sú dusičnany a dusitany v potravinách škodlivé? Získané z: Healthline.com
- « Teória sociálneho správania, typy, normy, príklady
- Tvorba binárnych zlúčenín, typy, príklady, nomenklatúra »

