Tvorba binárnych zlúčenín, typy, príklady, nomenklatúra
- 3785
- 283
- Adrián Fajnor
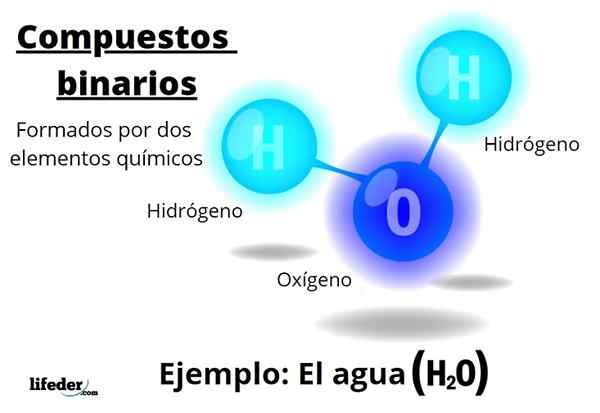
Ten binárne zlúčeniny Všetky sú tvorené dvoma chemickými prvkami, bez ohľadu na počet ich atómov alebo ich interakcie. Všeobecný vzorec pre tieto zlúčeniny jenBm, kde A a B sú dva rôzne prvky periodickej tabuľky a n a m ich príslušné stechiometrické koeficienty.
Napríklad voda, h2Alebo je to binárna zlúčenina, ktorá je snáď najreprezentatívnejšou z nich. Voda pozostáva z vodíka, H a kyslíka alebo, a tak pridanie dvoch chemických prvkov. Všimnite si, že jeho stechiometrické koeficienty naznačujú, že existujú dva atómy kyslíka a jeden kyslík, ale stále je to binárna zlúčenina.

Binárne zlúčeniny môžu pozostávať z iónov, molekúl, trojrozmerných sietí alebo dokonca neutrálnych atómov kovov. Dôležité je, že bez ohľadu na povahu jeho chemického väzby alebo zloženia je vždy tvorené dvoma rôznymi chemickými prvkami. Napríklad plynný vodík, h2, Nepočíta sa ako binárna zlúčenina.
Binárne zlúčeniny sa na začiatku nemusia zdať také hojné a komplexné v porovnaní s ternárnymi alebo kvartérnymi zlúčeninami. Medzi nimi je však mnoho základných látok pre suchozemské ekosystémy, ako sú soli, oxidy, sulfidy a niektoré plyny obrovskej biologickej a priemyselnej hodnoty.
[TOC]
Aké sú binárne zlúčeniny?
Metódy prípravy alebo syntetické trasy na vytvorenie binárnych zlúčenín budú závisieť od identity dvoch chemických prvkov A a B. V zásade a všeobecne sa však musia oba prvky kombinovať v reaktore, aby mohli navzájom interagovať. Ak sú teda podmienky priaznivé, uskutoční sa chemická reakcia.
Pri chemickej reakcii sa prvky A a B spoja alebo sa spoja (iónové alebo kovalentne), aby sa vytvorila zlúčenina donBm. Mnoho binárnych zlúčenín môže byť vytvorené priamou kombináciou svojich dvoch čistých prvkov alebo po iných ekonomickejších alternatívnych metódach.
Môže vám slúžiť: Oxid zinočnatého (ZnO): Štruktúra, vlastnosti, použitia, rizikáVráťte sa k príkladu vody, vodíka, h2, a kyslík, alebo2, Kombinujú pri vysokých teplotách, takže medzi nimi existuje spaľovacia reakcia:
2h2g) + alebo2g) → 2h2O (g)
Na druhej strane voda je možné získať dehydratačnými reakciami zlúčenín, ako sú alkoholy a cukry.
Ďalší príklad tvorby binárnej zlúčeniny zodpovedá sulfidu železnice, FES:
Viera (s) + s (s) → fes (s)
Kde tentoraz sú železo aj síra pevné a nie látky sódy. A to je rovnaké s niekoľkými binárnymi soľami, napríklad chloridom sodným, NaCl, kombináciou kovového sodíka s chlórskymi plynmi:
2NA (s) + cl2g) → 2NACL (s)
Menovanie
Názvy všetkých binárnych zlúčenín sa väčšinou riadia rovnakými pravidlami.
Pre zlúčeninu donBm, Názov B je uvedený ako prvý vo svojej aniónovej podobe; to znamená s koncom -uro. V prípade, že B sa však skladá z kyslíka, je pomenovaný ako oxid, peroxid alebo superoxid, ako sa uplatňuje.
Názov B predchádza grécke číselné predpony (Mono, Di, Tri, Tetra atď.) podľa hodnoty m.
Nakoniec je uvedený názov prvku A. V prípade, že má viac ako jednu valenciu, je naznačené rímskymi číslami a zátvorkami. Alebo ak je to preferované, môžete si vybrať tradičnú nomenklatúru a použiť prípony -ooso e -ico. Prvku A niekedy predchádzajú aj grécke číselné predpony podľa hodnoty n.
Zvážte nasledujúce binárne zlúčeniny spolu s ich príslušnými názvami:
-H2O: Oxid vodíka alebo oxid dihydrogénu (toto priezvisko je príčinou dráždenia)
-FES: sulfid železa (II) alebo sulfid železia
-NaCl: chlorid sodný alebo chlorid sodný
Môže vám slúžiť: olej alebo benzín éter: vzorec, štruktúra, použitie-Mgcl2: chlorid horečnatý, magnetický chlorid alebo dichlorid horečnatý
Všimnite si, že sa nehovorí „chlorid monosodia“ alebo „monohierro sulfid“.
Typy: Klasifikácia binárnych zlúčenín
Binárne zlúčeniny sú klasifikované podľa toho, čo sa tvoria alebo fakty: ióny, molekuly, atómy kovov alebo siete. Napriek tomu táto klasifikácia nie je úplne presvedčivá alebo definitívna, ktorá sa môže líšiť v závislosti od uvažovaného prístupu.
Iónový
V iónových binárnych zlúčeninách A a B pozostávajú z iónov. Tak pre zlúčeninu nanBm, B je zvyčajne anión, b-, Zatiaľ čo katión, do+. Napríklad NACL patrí tejto klasifikácii, ako aj do všetkých binárnych solí, ktorých všeobecné vzorce sú lepšie znázornené ako MX, kde X je anión a m kovový katión.
Fluoridy, chloridy, bromuros, jodid., Patrí tiež k tejto klasifikácii. Malo by sa však poznamenať, že niektoré z nich sú kovalentní, a preto patria k nasledujúcej klasifikácii.
Kovalentný
Kovalentné binárne zlúčeniny sú tvorené molekulami. Voda patrí tejto klasifikácii, pretože pozostáva z molekúl H-O-H. Chlorid vodíka, HCl, sa tiež považuje za kovalentnú binárnu zlúčeninu, pretože pozostáva z molekúl H-Cl. Všimnite si, že NaCl je iónový, zatiaľ čo HCl je kovalentný, oba chloridy sú.
Kovové alebo siete
Binárne zlúčeniny tiež pokrývajú zliatiny a tuhé látky troch rozmerovných sietí. Avšak pre nich sa denominácia binárnych materiálov zvyčajne používa lepšie.
Napríklad mosadz, viac ako zlúčenina, sa považuje za binárny materiál alebo zliatinu, pretože je tvorený meďou a zinkom, Cu-Zn. Všimnite si, že nie je napísané tým, že nemá definované stechiometrické koeficienty.
Podobne je tu oxid kremíka, SIO2, tvorené kremíkom a kyslíkom. Ich atómy sú spojené definovaním trojrozmernej siete, kde nemôžete hovoriť o molekulách alebo iónoch. Mnoho nitridov, fosfónu a karbidov, keď nie sú iónové, je tiež o tomto type sietí.
Môže vám slúžiť: kyselina fenoxyaktová: syntéza, postup, použitie, rizikáPríklady binárnych zlúčenín
 Voda je príkladom binárnej zlúčeniny
Voda je príkladom binárnej zlúčeniny Bude uvedený na dokončenie niekoľkých binárnych zlúčenín sprevádzaných ich príslušnými názvami:
-LIV: Lítium Bromid
-Kacl2: chlorid vápenatý
-Fecl3: chlorid železa (III) alebo chlorid železitý
-NAO: oxid sodný
-Brať do úvahy2: hydrid berylia
-Co2: oxid uhličitý
-NH3: Trihydrid dusíka alebo amoniaku
-HDP2: Olovo jodid (ii) alebo olovo diyoduro
-Mg3N2: Nitruro horčík
-Do2Ani3: Oxid hlinitý alebo oxid diaumín
-Nat3Otázka: Fosfuro sodný
-ALF3: Hliníkový fluorid
-Rukl2: Rádio chlorid alebo rádiový dichlorid
-Bf3: Boro trifluoruro
-RBI: Rubidio Yoduro
-WC: Karbid volfrámu alebo Wolframium
Každý z týchto príkladov môže mať naraz viac ako jedno meno. Z toho CO2 Má veľký vplyv na prírodu, pretože ju používajú rastliny v procese fotosyntézy.
Na druhej strane NH3 Je to jedna z látok s najväčšou priemyselnou hodnotou, ktorá je potrebná na syntézu polymérnej a organickej syntézy. A nakoniec, WC je jedným z najťažších materiálov, aký bol kedy vytvorený.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Artem Cheuprasov. (2020). Čo je binárna zlúčenina? - Definícia a príklad. Štúdium. Získané z: štúdie.com
- HelMestine, Anne Marie, PH.D. (11. februára 2020). Definícia binárnej zlúčeniny. Zotavené z: Thoughtco.com
- Byju's. (2020). Čo sú binárne zlúčeniny? Získané z: Byjus.com
- Chemička. (s.F.). Binárne zlúčeniny kovov s pevnými nábojmi. Získané z: Chemteam.Info
- Wikipedia. (2020). Binárna fáza. Zdroj: In.Wikipedia.orgán
- « Vlastnosti dusitanov, štruktúra, nomenklatúra, školenie
- Reakčná flokulácia, typy, aplikácie, príklady »

