Vlastnosti dusičnanov, štruktúra, nomenklatúra, školenie
- 4187
- 1120
- MUDr. Miloslav Habšuda
Ten Dusičnany Sú to všetky tie zlúčeniny, ktoré obsahujú anión3-, Pokiaľ ide o anorganické soli alebo skupinu nitro, -ono2, V prípade organických derivátov. V anorganickom sú všetky dusičnany kovové soli alebo ión amónny, v ktorých prevažuje elektrostatické interakcie mn+Nie3-.
Napríklad dusičnan sodný3, Tvorí sa na ióny+ a nie3-. Táto soľ, spolu s dusičnanom draselným, KNO3, sú najhojnejšie vzorky dusičnanov v prírode. Dusičnany nájdené v pôdach, v rastlinných tkanivách a predovšetkým v moriach a soľných ložiskách, ako je Saliter, sa nachádza v Čile.
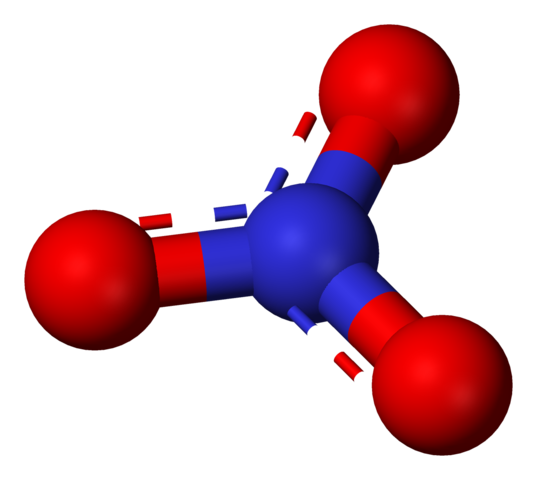
 Anión dusičnanu predstavovaný modelom sfér a tyčí. Zdroj: Benjah-Bmm27 / verejná doména.
Anión dusičnanu predstavovaný modelom sfér a tyčí. Zdroj: Benjah-Bmm27 / verejná doména. Termín „dusičnany“ sa okamžite naráža na soli, hnojivá a výbušniny. Sú tiež príbuzné s mäsom a ich vytvrdzovacími procesmi na inhibíciu rastu baktérií, a tak oneskorenie ich zhoršenia. Dusičnany sú tiež synonymá pre zeleninu, pretože obsahujú veľké množstvo týchto solí.
On nerobí3- (vynikajúci obraz) je najviac oxidovaná forma dusíka, ktorá je konečným a asimilovateľným produktom jeho biologického cyklu. Dusík atmosféry trpí niekoľkými transformáciami, buď prácou elektrických lúčov, alebo prostredníctvom mikrobiálnych akcií, aby sa stala NH4+ a nie3-, Rozpustné vo vode a absorbovateľné rastlinami.
Dusičnany sa používajú ako oxidačné činidlá, hnojivá, výbušniny a kardiologické lieky. Toto posledné použitie veľa kontrastuje s ostatnými, pretože metabolizujú alebo interagujú s telom takým spôsobom, že sa rozširujú žily a tepny; A preto sa zvyšuje a zlepšuje prietok krvi, zmierňuje bolesti srdca.
[TOC]
Dusičnany
Neutralita
Dusičnany sú v zásade neutrálne látky, pretože nie3- Je to konjugovaná základňa kyseliny dusičnej, HNO3, Silná kyselina. Vo vode to nie je značné:
Nie3- + H2Alebo hno3 + Oh-
V skutočnosti sa dá povedať, že táto hydrolýza sa nevyskytuje vôbec, množstvo OH, ktoré sú opovrhnutiahodné-. Preto sú roztoky vodných dusičnanov neutrálne, pokiaľ neexistujú iné rozpustené látky.
Fyzický vzhľad
Anorganické dusičnany pozostávajú zo soli, ktorých všeobecné vzorce sú m (nie3)n, bytosť n Je to Valencia alebo kladné zaťaženie kovového katiónu. Všetky tieto dusičnany majú kryštalický jas a majú belavé farby. Dusičnany pre prechodné kovy však môžu byť farebné.
Napríklad dusičnan meďnatého (II) alebo dusičnanový dusičnan, cu (nie3)2, Je to modrú kryštalická tuhá látka. Medzitým nikel dusičnan (ii), ani (nie3)2, Je to solídna smaragdová farba. Niektoré ďalšie dusičnany, napríklad železo, predstavujú slabé farby.
Na druhej strane sú organické dusičnany zvyčajne vysoko citlivé a výbušné tuhé látky alebo tuhé látky.
Môže vám slúžiť: Living Matter: Koncept, charakteristiky a príkladyTepelný rozklad
Dusičnany kovov sú citlivé na vysoké teploty, pretože sa začínajú rozkladať podľa nasledujúcej chemickej rovnice:
2 m (nie3)2(S) → 2M (s)+4NO2g)+alebo2g)
Ako bolo pozorované, dusičnan kovový dusičnan sa rozkladá na oxid, mo a dusík a kyslíkový oxid. Tento tepelný rozklad sa nevyskytuje pri rovnakej teplote pre všetky dusičnany; Niektorí odolávajú viac ako ostatní.
Spravidla, čím väčšie a menšie je zaťaženie katiónov M je+, Väčšia bude teplota, pri ktorej sa musí dusičnan zahriať, aby sa rozložil. Namiesto toho, keď m+ Je malá alebo má veľké pozitívne zaťaženie, dusičnany sa rozkladajú pri nižších teplotách, preto nestabilnejšie.
Napríklad dusičnan sodný3, Rozkladá sa pri teplote nižšej ako teplota dusičnanu, BA (nie3)2, No, hoci BA2+ mať väčšie zaťaženie ako na+, Jeho veľkosť je oveľa väčšia.
Oxidačný činiteľ
On nerobí3- Je to relatívne stabilný anión. Jeho atóm dusíka je však silne oxidovaný, s oxidačným stavom +5 (n5+Ani32-), Takže je to „smäd“ elektrónov. Z tohto dôvodu je dusičnan oxidačným činidlom, ktoré sa bude snažiť chytiť látky elektróny okolo neho.
Je to tento nedostatok elektrónov v atóme dusíka NO3- Čo robí nano3 A kotle3 Silné oxidačné činidlá, ktoré sa používajú ako komponenty strelného prachu. Pridáva k tejto charakteristike skutočnosť, že sa uvoľňujú plyny2 I2 Pri rozkladaní sa chápe, prečo je súčasťou mnohých výbušnín.
Keď dusičnan získava elektróny alebo redukuje, môže sa transformovať na amoniak, NH3, alebo v oxidu dusnatého, nie, v závislosti od reagencií a podmienok.
Rozpustnosť
Všetky anorganické dusičnany alebo to, čo je rovnaké, kovové a amónne dusičnany, NH4Nie3, Sú to zlúčeniny rozpustné vo vode. Je to preto, že molekuly vody majú silnú afinitu k nie3-, A že kryštalické siete týchto dusičnanov nie sú príliš stabilné.
Štruktúra
Anión dusičnanu
 Rezonančné štruktúry dusičnanov. Zdroj: Benjah-Bmm27 / verejná doména.
Rezonančné štruktúry dusičnanov. Zdroj: Benjah-Bmm27 / verejná doména. Horný obrázok zobrazuje rezonančné štruktúry dusičnanového aniónu. Ako je zrejmé, dve negatívne náboje sú umiestnené v dvoch atómoch kyslíka, ktoré sú demokalizované medzi tromi atómami kyslíka. Preto každý alebo má zaťaženie -2/3, zatiaľ čo dusík má zaťaženie +1.
Takže nie3- Elektrostaticky interakcia alebo forma koordinácie spojenia prostredníctvom ktoréhokoľvek z jeho troch atómov kyslíka.
Tuhá látka
Všetky anorganické dusičnany sú soľné a iónové. Preto sú jeho štruktúry kryštalické, čo znamená, že jeho ióny, m+ a nie3-, Sú usporiadané vo vesmíre vďaka svojim elektrostatickým interakciám. V závislosti od týchto interakcií budú ich kryštály predstavovať rôzne štruktúry.
Môže vám slúžiť: Čo je to bezpečnostný rhombus a na čo je to pre?Napríklad kryštalická štruktúra Nano3 Je to trigonálne alebo rhomboédiica, zatiaľ čo Kno3 Je ortorrombický.
Organické dusičnany
Organické dusičnany sú zastúpené všeobecným receptom Rono2, kde r je alkyl alebo aromatická skupina. Tieto zlúčeniny sa vyznačujú ich R-Aon Link2, a zvyčajne pozostávajú z dusičných derivátov polymérov a iných organických látok.
Komplex
On nerobí3- Koordinuje sa s kovovými centrami, aby vytvorila odkaz M Link+-ALEBO NIE2-, byť inou interakciou ako iónová. Tieto komplexy sú v podstate anorganickou povahou. Dusičnan môže byť dokonca koordinovaný pomocou dvoch z jeho atómov kyslíka súčasne, m+-Ani2Nie.
Menovanie
Na vymenovanie dusičnanu musia byť najskôr napísané slová „dusičnan“, po ktorom nasleduje meno katiónu alebo skupina, ktorá ho sprevádza v príslušnom chemickom vzorec. Valencia katiónu je špecifikovaná v zátvorkách, keď má viac ako jednu. Podobne je možné použiť prípony -Co a -y, ak sú to preferované, podľa tradičnej nomenklatúry.
Napríklad zvážte vieru (nie3)3. Jeho názov je železný dusičnan (III), pretože jeho valencia je +3 alebo sa dá nazvať aj dusičnanu železitý.
Tieto pravidlá sa vzťahujú aj na organické dusičnany za predpokladu, že ich štruktúry sú jednoduché. Napríklad Cho3ALEBO NIE2 Nazýva sa metylstirát, pretože skupina -ch skupina3 Stáva sa skupinou R, ktorá sprevádza -ono2.
Výcvik
Prirodzený
Dusičnany sa tvoria v prírode ako súčasť biologického cyklu dusíka. Z tohto dôvodu majú pôdy, moria a niektoré vodné prúdy značné množstvo dusičnanov. V závislosti od okolitých iónov sa vytvoria rôzne dusičnany3 A kotle3 Najbežnejšie a najhojnejšie.
Priemyselný
Dusičnany sa tvoria v priemyselných mierkach neutralizáciou kyseliny dusičnej, buď s kovovými hydroxidmi, alkoholmi, polymérmi atď. Napríklad dusičnan vápenatý, CA (NO3)2, Môže sa pripraviť podľa nasledujúcej chemickej rovnice:
CA (OH)2 + 2Hno3 → CA (nie3)2 + 2h2Ani
Podobne niekoľko organických látok napadá HNO3 Za určitých podmienok na podporu nahradenia niektorých svojich skupín podľa -ono2. To sa deje s reakciou celulózy na transformáciu na nitrocelulózu alebo dusičnan celulózy, polymérny a výbušný materiál.
Fotokatalytický
Anión nie3-, A preto anorganické dusičnany môžu byť tvorené fotokatalytickým pôsobením odpadu z oxidu titánu, strýko2, Použitie ako suroviny nič viac ako dusík a kyslík vzduchu. Táto štúdia predpokladá, že tam, kde existujú excesy chlapíka2, bude nežiaduce množstvá NO3-, ktoré ovplyvňujú náčinnosť vo vode a môžu obsahovať riasy.
Môže vám slúžiť: aldehydosŽiadosti
Vytvrdzovanie mäsa
 Klobásy sú jedným z spracovaných mäsov, ktoré obsahuje viac dusičnanov. Zdroj: pxhere.
Klobásy sú jedným z spracovaných mäsov, ktoré obsahuje viac dusičnanov. Zdroj: pxhere. Dusičnany sa pridávajú k niekoľkým mäsom, najmä klobásom, na odstránenie baktérií, a tak oneskorenie ich zhoršenia. Reagujú tiež so svojimi proteínmi, aby im poskytli červenkastejšiu farbu. Problém týchto mäsa je v tom, že ich varením pri vysokých teplotách produkujú nitrosoamíny: zlúčeniny spojené s rakovinou hrubého čreva.
Tomuto reakcii sa čiastočne vyhýba, ak sú prítomné vitamíny, ako je to v prípade zeleniny, ktorá, aj keď sú bohaté na dusičnany, nie sú spojené s karcinogénnymi patológiami.
poľnohospodárstvo
Dusičnany sú rozpustným zdrojom dusíka. Preto slúži ako hnojivo na prispievanie dusíka do rastlín, a preto uprednostňuje ich rast.
Liek
Dusičnany majú v tele špeciálnu funkciu. Pri asimilácii enzymatickým účinkom sa redukuje na oxid dusnatého, nie. Táto molekula zaberá objem a rozširuje žily a tepny, čo umožňuje väčší prietok krvi. Preto sa dusičnany používajú ako lieky na boj proti patológiám obehového systému.
Na tento účel sa použili ironické a zvedavé organické dusičnany, ako je glycerí, nitroglycerín, izosorbidný mononitrát a pentaeritritol tetrarát, všetci dobrí kandidáti vo svete výbušnín.
Výbušniny
Dusičnany sa používajú v výbušných formuláciách, strelec je najeteľnejším príkladom. Byť oxidačnými činidlami uprednostňujú spaľovanie hmoty, okrem toho, že prispeli k náhlemu rozšíreniu objemu v dôsledku uvoľňovania plynov po rozkladu.
Príklady dusičnanov
V predchádzajúcich oddieloch bolo uvedených viac ako jeden príklad dusičnanov. Nakoniec budú niektorí iní uvedení spolu s príslušnými vzorcami a menami:
-Ľan3: Lítium dusičnan
-Rbno3: Rubidio dusičnan
-Mg (nie3)2: Dusičnan horečnatý
-SC (nie3)2: Scandio dusičnan
-CR (nie3)3: Chrómový dusičnan (iii)
-Zn (nie3)2: dusičnan zinku
-PB (nie3)2: Dusičnan olovo (II)
-Agno3: dusičnan strieborný
-Chvály3Chvály2ALEBO NIE2: Etyl -nitrát
-Chvály3(Ch2)4ALEBO NIE2: Amilo dusičnan
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Clark J. (5. júna 2019). Tepelná stabilita dusičnanov a uhličitanov. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Wikipedia. (2020). Dusičnan. Zdroj: In.Wikipedia.orgán
- Angela Dowden. (12. marca 2019). Pravda o dusičnanoch vo vašom jedle. Zdroj: BBC.com
- Elsevier B.Vložka. (2020). Dusičnan. Vedecký. Zdroj: ScienceDirect.com
- DR. Biji s. A prof. Govindan v. (26. apríla 2017). Úloha organických dusičnanov pri optimálnom lekárskom riadení angíny. Európska spoločnosť kardiológie. Získané z: Escardio.orgán
- Yuan, s., Chen, J., Lin, z. a kol. (2013). Tvorba dusičnanov z atmosférického dusíka a kyslíka fotokatalyzovaná nano-sedovým oxidom titaničitého. Nat Commun 4, 2249. doi.org/10.1038/ncomms3249
- « Naratívna terapia Základy Michaela Whitea, postup, techniky
- Epoxidová nomenklatúra, získanie, aplikácie, príklady »

