Epoxidová nomenklatúra, získanie, aplikácie, príklady
- 4468
- 710
- JUDr. Rudolf Čapkovič
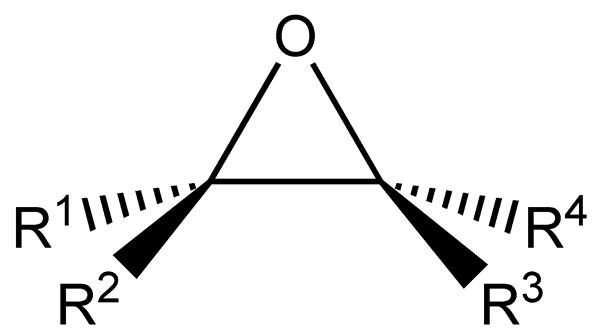
Ten Epoxidy Sú to alifatické alebo cyklické uhľovodíky, ktoré majú atóm kyslíka v rovnakom čase s dvoma atómami uhlíka v ich štruktúre. Tento odkaz, ako je vidieť na spodnom obrázku, predstavuje trojuholníkovú geometriu, ktorá je celkom charakteristická pre všetky epoxidy.
Epoxidy pochádzajú z alkénov, ktoré trpia prasknutím dvojitého väzby za vzniku funkčnej skupiny epoxidu. Každý z dvoch atómov spojených s kyslíkom je tiež spojený s bočnými skupinami r1, R2, R3 a r4, všetky časti tej istej molekuly.
 Štrukturálny a všeobecný vzorec pre epoxidy. Zdroj: Tomas Kindahl / Public Domain.
Štrukturálny a všeobecný vzorec pre epoxidy. Zdroj: Tomas Kindahl / Public Domain. Funkčná skupina epoxidu sa vyznačuje veľkým napätím, ktoré poskytuje väčšiu reaktivitu ako reaktivita necyklického éteru. Epoxidové reakcie sú zvyčajne sprevádzané prasknutím ich funkčnej skupiny.
Najjednoduchší epoxid zodpovedá epoxidu etánu, ktorý sa tiež nazýva etylénoxid, etylénový oxid alebo oxirano. Zo všetkého je to epoxid väčšieho komerčného významu.
Najväčší podiel výroby epoxidu je určený na maľovanie (povrchové povlaky). Používajú sa tiež na výrobu povrchovo aktívnych látok, lepidiel, plastifikátorov atď.
[TOC]
Menovanie
Zlúčeniny s epoxidovou funkčnou skupinou sa môžu volať rôznymi spôsobmi, ako napríklad: epoxid, epoxidy alebo iné názvy bez akejkoľvek systematickej konotácie, ako napríklad: Oxirano.
Epoxidy s jednoduchšími chemickými štruktúrami sa zvyčajne nazývajú oxidy. Týmto spôsobom propeno epoxid (c3H6) Sa nazýva oxid propeno (c3H6Buď).
Je bežné, že sa nazývajú epoxid identifikujúce uhlíky, ktoré sú prítomné vo funkčnej skupine epoxidu. Napríklad: 2,3-epoxyhexan, 1,2-epoxychiclohexan a 1,2-epoxipropán. To znamená, že „trojuholník“ sa nachádza v uhlíkoch 2 a 3 hexánu a tak ďalej s cyklohexanom a propánom.
Môže vám slúžiť: EnthalpiaZískanie
Katalytická oxidácia
Epoxid etno alebo etylénoxid sa pripravuje katalytickou oxidáciou etylénu v horúcom vzduchu alebo kyslíku, ktorá sa používa ako katalyzátor kovového striebra:
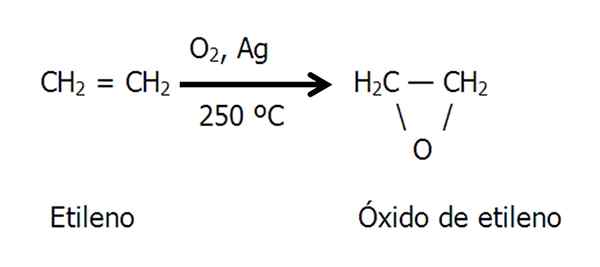 Rovnica pre syntézu etylénoxidu. Zdroj: Gabriel Bolívar.
Rovnica pre syntézu etylénoxidu. Zdroj: Gabriel Bolívar. Chlórhydrin
Táto metóda sa vykonáva v dvoch štádiách: a) tvorba chlórhydrínu a b) ošetrenie chlórhydrínu s základom na odstránenie kyseliny chlorovodíkovej.
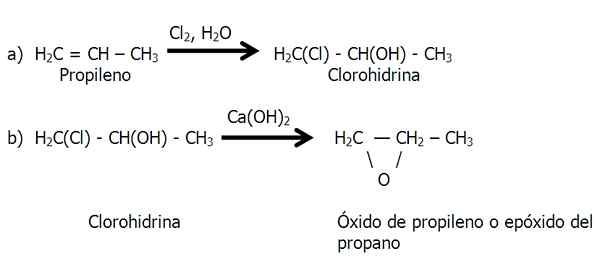 Fázy metódy chlórhydrínu pre syntézu epoxidu. Zdroj: Gabriel Bolívar.
Fázy metódy chlórhydrínu pre syntézu epoxidu. Zdroj: Gabriel Bolívar. V štádiu B) sa stratí molekula HCL, ktorej vodík pochádza zo skupiny OH.
Peroxidácia dvojitého väzby uhlíka-uhlík
Epoxidy môžu byť tiež tvorené peroxidáciou alkénov, to znamená oxidáciu spôsobenou kriminálnikou, ako je kyselina peroxibenzoová:
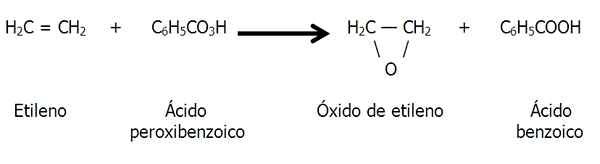 Peroxidácia etylénu za vzniku etylénexidu alebo epoxidu etánu. Zdroj: Gabriel Bolívar.
Peroxidácia etylénu za vzniku etylénexidu alebo epoxidu etánu. Zdroj: Gabriel Bolívar. Prírodná prítomnosť epoxidov
Epoxidy sú svojou povahou neobvyklé. Syntéza pečene však bola pozorovaná, sprostredkovaná cytochrómom P450. Bunky produkujú epoxidy ako oxidačné produkty alquenos a aromatických zlúčenín.
Zlúčeniny, ako sú epotylony.
Žiadosti
Príprava povrchovo aktívnych látok
Etylénoxid sa často používa pri príprave povrchovo aktívnych látok, alkoholových alebo fenolových reakčných produktov s etylénoxidom. Povrchovo aktívne látky spĺňajú rôzne funkcie vrátane: zvlhčovače, detergenty, emulgátory a solubilizátory.
Zvlhčovače zvyšujú hydratáciu povrchu uľahčovaním prístupu k vode k nim. Čistiaci prostriedok eliminujte nečistoty z oblečenia. Emulzie umožňujú a stabilizujú emulzie. A solubilizátory umožňujú rozpustenie niekoľkých miešateľných zlúčenín vodou.
Môže vám slúžiť: Fick LawLepidlá a rozpúšťadlá
Reakcia epoxidov vrátane etylénexidu, s amínmi je základom prípravy frontov alebo ďasien pasty. Tieto lepidlá sa používajú na výrobu spojenia povrchov, ako aj na stabilizáciu PVC.
Etylénoxid reaguje s etoxidom sodným za produkciu 2-toxietanolu, známy tiež ako Cellavelve. Táto chemická zlúčenina rozpúšťa oleje, živice, tuky, vosky, nitrocelulózu a LACAS.
Epoxidové živice
Epoxid alebo epoxidové živice majú medzi ich vlastnosti, keď boli posilnené, vysoká chemická, tepelná a mechanická odolnosť. Tieto odpory umožňujú ich použitie na vypracovanie LACA a smaltov, ako aj na poťahovanie kovov a laboratórnych podláh a výrobu elektrických častí.
Niektoré spoločnosti používajú tieto živice s výplňami oxidu kremičitého, ktoré nahradia porcelán na výrobu izolátorov elektrickej linky. Epoxidové živice sa tiež používajú na výrobu listov pre tlačené obvody a dosky vystužené sklenenými vláknami.
Epoxidové živice majú len málo použití osobitne, vrátane vinylovej stability. Na zvýšenie ich užitočnosti sú krížovo spojené s niekoľkými zlúčeninami v procese známeho ako „vyliečené“. Medzi činidlami použitými na tento účel máme: primárne, sekundárne, terciárne a polyamidy.
Epoxidy získané z rastlinných olejov sa používajú na syntézu detskej obrny, ktoré sa používajú v polyuretánovom priemysle.
Lekárske použitie
Epotylony sú metabolické produkty baktérií Sorangium Cellulosum, ktoré majú vlastnosť stabilizačných mikrotubulov, čím vytvárajú blokovanie bunkového cyklu.
Použitie ixabepilonu, epotylonov, bolo schválené na liečbu pokročilého rakoviny prsníka. Podobne sa používalo použitie epotylonu D pri liečbe Alzheimerovej choroby.
Môže vám slúžiť: kyselina disulfurová: čo je, štruktúra, vlastnosti, použitiaIné použitia
Etylénoxid zasahuje do syntézy etylénglykolu: zlúčenina použitá ako nemrznúca zmes v chladiacich systémoch Cars. Etylénoxid sa používa aj pri sterilizácii zdravotných materiálov a nástrojov.
Toxicita
Absorpcia kožou, vdýchnutie alebo príjem epoxidu sú spojené s produkciou toxických účinkov, a to u človeka aj experimentálnych zvierat. Patria sem: podráždenie povrchových tkanív a senzibilizácie. Vyrábajú sa aj zmeny vo fungovaní pečene, krvinky a kostnej drene.
Podobne aj epoxidy s karcinogenitou a mutagénnosťou súviseli s epoxidmi. Eporoxidy sa kvôli ich vysokej elektrofylovej reaktivite a charakteru prenajatých zlúčenín považovali za potenciálne karcinogénne činidlá.
Príklady epoxidov
Nakoniec budú uvedené niektoré ďalšie príklady epoxie:
-1,2-epoxipropán
-2,3-epoxyhexan
-1,2-epoxyclohexan
-Oxid na roztiahnutie
-Oxid izobutilénu
-3,4-Epoxi-1-Butno
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10th Vydanie.). Wiley Plus.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Morrison a Boyd. (1987). Organická chémia. (Piate vydanie). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Epoxid. Zdroj: In.Wikipedia.orgán
- Leroy G. Brodiť. (2020). Epoxid. Encyclopædia Britannica. Získané z: Britannica.com
- Manson M. M. (1980). Epoxidy: Existuje problém s ľudským zdravím? British Journal of Industrial Medicine, 37(4), 317-336. doi.org/10.1136/OEM.37.4.317
- Chemikálie. (s.F.). Príklady epoxidov. Obnovené z: chemiky.slepo
- W.G. Hrnčiar. (1963). Chémia a použitie epoxidových živíc, povolania, zväzok 13, vydanie 1, apríl 1963, strany 42-47, doi.org/10.1093/Occmed/13.1.42
- Molinero Muñoz, María a Fernández Arberas, Nerea. (2016). Epotylonas, alternatíva v oblasti protinádoru. Computtentense Madrid University.
- Alejandro Aguirre f. & Lesly espinoza b. (2018). Použitie a aplikácie epoxidov a sulfidov. Ekvádorská univerzita. Zotavené z: akadémie.Edu
- « Vlastnosti dusičnanov, štruktúra, nomenklatúra, školenie
- Cannizzaro reakčné charakteristiky, mechanizmy, príklady »

