Štruktúra dusičnanu strieborného (AGNO3), vlastnosti, použitie, toxicita

- 4046
- 546
- Adrián Fajnor
On dusičnan Je to anorganická soľ, ktorej chemický vzorec je agno3. Zo všetkých strieborných soli je to najkonomómnejší a ten, ktorý predstavuje relatívnu stabilitu proti slnečnému žiareniu, takže má tendenciu rozkladať sa menej. Je to rozpustný a predchádzajúci zdroj striebra v každom laboratóriu výučby alebo výskumného laboratória.
Pri výučbe sa na výučbu reakcií na zrážanie chloridu v vodnom dusičnanoch používajú roztoky dusičnanov. Podobne sa tieto roztoky spoja do kontaktu s kovovou meďou, aby sa uskutočnila reakcia Rédox, v ktorej kovové striebro precipituje uprostred formovaného rozpustenia dusičnanu meďnatého, CU (nie3)2.
 Kontajner vzorky dusičnanu strieborného. Zdroj: W. Oelen/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)
Kontajner vzorky dusičnanu strieborného. Zdroj: W. Oelen/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Na hornom obrázku je zobrazená fľaša so strieborným dusičnanom. Môže byť vystavený svetlu bez stmavnutia jeho kryštálov, produkt vzhľadu oxidu striebra.
Podľa alchymických zvykov a antibakteriálnych vlastností kovového striebra sa dusičnan strieborný dusičnan používa na dezinfekciu a kauterizáciu rán. Na tento účel sa však používajú veľmi zriedené vodné roztoky alebo jeho tuhá látka zmiešaná s dusičnanom draselným aplikovaným špičkou drevených prútov.
[TOC]
Štruktúra dusičnanov striebra
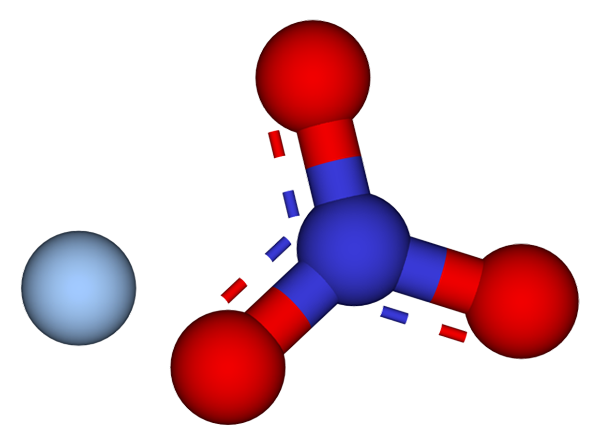 Ióny, ktoré tvoria kryštály dusičnanov strieborného. Zdroj: CCOIL/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)
Ióny, ktoré tvoria kryštály dusičnanov strieborného. Zdroj: CCOIL/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Na hornom obrázku sú zobrazené ióny AG+ a nie3- dusičnanu striebra, ktorý je predstavovaný modelom guľôčok a tyčí. Agno vzorec3 Označuje stechiometrický podiel tejto soli: pre každú katiónovú ag+ Nie je anión3- Elektrostaticky interakcia s ním.
Môže vám slúžiť: Síra: História, vlastnosti, štruktúra, získavanie, použitie, použitiaAnión nie3- (z červených a modroférových guľôčok) má trigonálnu plochú geometriu, pričom negatívne zaťaženie de detekuje medzi tromi atómami kyslíka. Preto dochádza k elektrostatickým interakciám medzi týmito dvoma iónmi medzi katiónom AG+ A atóm kyslíka aniónu nie3- (AG+-ALEBO NIE2-).
Týmto spôsobom, každý AG+ skončí koordináciou alebo okolo troch no3- susedia v rovnakej rovine alebo kryštalografickej vrstve. Zoskupenie týchto lietadiel skončí definovaním kryštálu, ktorého štruktúra je ortorrombická.
Príprava
Dusičnan strieborný sa pripravuje útočením na vyhorený kovový kus striebra s kyselinou dusičnou, či už studený alebo horúci koncentrovaný:
3 ag + 4 hno3 (zriedené) → 3 agno3 + 2 h2O +nie
Ag + 2 hno3 (koncentrované) → Agno3 + H2O +nie2
Všimnite si tvorbu plynov nie a nie2, ktoré sú toxické a vynútia túto reakciu, aby sa nemali vykonávať mimo zvončeka extraktora.
Fyzikálne a chemické vlastnosti
Fyzický vzhľad
Bezfarebná kryštalická pevná látka, toaleta, ale veľmi horká chuť.
Molárna hmota
169 872 g/mol
Bod topenia
209,7 ° C
Bod varu
440 ° C. Pri tejto teplote však trpí tepelným rozkladom, v ktorom sa vyskytuje kovové striebro:
2 agno3(l) → 2 ag (s) + o2 g) + 2 nie2 g)
Neexistujú žiadne pary agno3, Aspoň nie v pozemských podmienkach.
Rozpustnosť
Agno3 Je to neuveriteľne rozpustná úspora vody, ktorá má rozpustnosť 256 g/ 100 ml pri 25 ° C. Je tiež rozpustný v iných polárnych rozpúšťadlách, ako je amoniak, kyselina octová, acetón, éter a glycerol.
Hustota
4,35 g/cm3 pri 24 ° C (okolitá teplota)
Môže vám slúžiť: destilovaná voda3,97 g/cm3 pri 210 ° C (práve v bode topenia)
Stabilita
Agno3 Je to stabilná látka vždy, keď je správne uložená. Nebude zapálený pri žiadnej teplote, hoci sa dá rozbiť uvoľnením toxických výparov oxidov dusíka.
Na druhej strane, hoci dusičnan strieborný nie je horľavý, je to silné oxidačné činidlo, ktoré pri príchode do kontaktu s organickými látkami a zdrojom tepla je schopné spustiť exotermickú a výbušnú reakciu.
Okrem toho by táto soľ nemala byť vystavená príliš veľa času na slnečné svetlo, pretože ich kryštály sú stmavené kvôli tvorbe oxidu striebra.
Použitie dusičnanu striebra
Zrážanie a analytické činidlo
V predchádzajúcej časti bolo uvedené zmienka o neuveriteľnej rozpustnosti AGNO3 Vo vode. To znamená, že AG ióny+ Budú sa rozpustiť bez problémov a budú k dispozícii na interakciu s akýmkoľvek vodným médiom iónom, ako sú halogenidové anióny (x = f-, Cl-, Br- a ja-).
Striebro ako ag+, A po pridaní HNO3 zriedené, vyzráža prítomné fluoridy, chloridy, bromidy a jodidy, ktoré pozostávajú z bielych alebo žltkastých tuhých látok:
Zápis+(ac) +x-(Ac) → Agx (s)
Táto technika sa veľmi opakuje na získanie halogenúrov a používa sa tiež v mnohých kvantitatívnych analytických metódach.
Mýto
Agno3 Zohráva tiež analytickú úlohu v organickej chémii, pretože je hlavným činidlom vedľa amoniaku na prípravu činidla Tollens Reagent. Toto činidlo sa používa v kvalitatívnych pokusoch, ktoré umožňujú určiť prítomnosť aldehydov a ketónov vo vzorke problému.
Syntéza
Agno3 Je to vynikajúci rozpustný zdroj striebra iónov. To, okrem relatívnych a nízkych nákladov, z neho robí požadované činidlo pre nespočetné organické a anorganické syntéza.
Môže vám slúžiť: Gibbs Free Energy: Jednotky, ako sa vypočítava, vyriešené cvičeniaBez ohľadu na reakciu, ak potrebujete ag ióny+, Je teda celkom pravdepodobné, že chemikálie sa uchýlia k Agne3.
Liečivý
Agno3 Pred objavením moderných antibiotík mal v medicíne veľa popularity. Dnes sa však stále používa v konkrétnych prípadoch, pretože má vlastnosti Caulster a Antibakteriálne vlastnosti.
Zvyčajne sa zmieša s Kno3 Na špičke drevených prútov, takže je vyhradený výlučne na topické použitie. V tomto zmysle slúžilo na liečbu bradavíc, rany, infikovaných nechtov, nosných úst vredov a krvácania. Zmes Agno3-Pokaziť sa3 CAUTERIZA Koža ničí poškodené tkanivo a baktérie.
Baktericídny účinok Agno3 Používa sa tiež na čistenie vody.
Toxicita a vedľajšie účinky
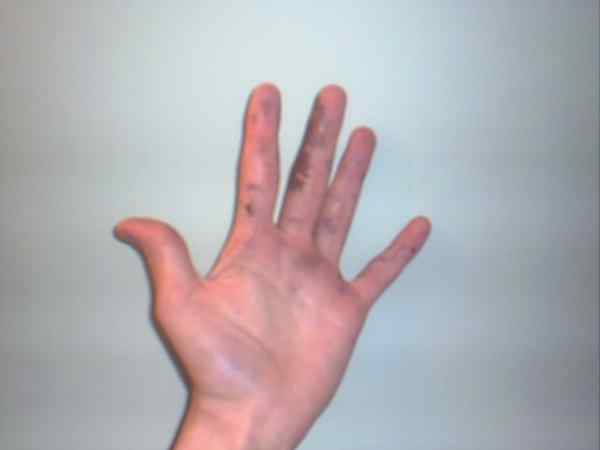 Dusičnan strieborný môže spôsobiť popáleniny, ktoré sú zobrazené ich fialovými alebo tmavými škvrnami. Zdroj: Jane z Baden v angličtine Wikipedia / Public Domain
Dusičnan strieborný môže spôsobiť popáleniny, ktoré sú zobrazené ich fialovými alebo tmavými škvrnami. Zdroj: Jane z Baden v angličtine Wikipedia / Public Domain Aj keď je dusičnan strieborný stabilný plat a nepredstavuje príliš veľa rizík, je to vysoko žieravá tuhá látka, ktorej požitie môže spôsobiť vážne gastrointestinálne poškodenie.
Preto sa odporúča jeho manipulácia s rukavicami. Môže spáliť pokožku av niektorých prípadoch ju stmavne, až kým nezmení fialový stav alebo ochorenie známe ako Argíria.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Dusičnan. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2020). Dusičnan. Databáza pubchem., CID = 24470. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Elsevier B.Vložka. (2020). Dusičnan. Vedecký. Zdroj: ScienceDirect.com
- University of Iowa. (2020). Používanie dusičnanov strieborného dusičnanu a toxicita. Získané z: medicíny.Uiowa.Edu
- P.F. Lindley & P. Lesný. (1966). A X-Ray Research of Silver Dusičnan: jedinečná štruktúra dusičnanov kovu. Journal of the Chemical Society A: Anorganic, Physical, Teoretical.
- Lucy Bell Young. (2020). Aké sú lekárske použitia dusičnanu striebra. Chemikálie činidla. Obnovené z: chemikálií.co.Uk
- « Piperidínová štruktúra, syntéza, deriváty, reakcie
- C ++ História, charakteristiky, typy údajov, príklady »

