Dipolárny moment, ako sa vypočíta a príklady

- 2479
- 143
- Ing. Ervín Petruška
On Dipolárny moment Je to chemická vlastnosť, ktorá naznačuje, ako sú heterogénne elektrické náboje distribuované v molekule. Je vyjadrená v jednotkách Debye, 3,33 · 10-30 C · m a zvyčajne ich hodnoty sa pohybujú od 0 do 11 d.
Vysoko polárne zlúčeniny majú tendenciu mať veľké dipólové momenty; zatiaľ čo apolárne, malé dipólové momenty. Čím viac polarizovaných elektrických nábojov sú v molekule, tým väčší je jeho dipólový moment; to znamená, že musí existovať oblasť bohatá na elektróny, δ- a ďalší chudobní v elektronoch, δ+.
 Tento dvoma skorer. Zdroj: pexels.
Tento dvoma skorer. Zdroj: pexels. Dipólový moment, μ, je veľkosť vektora, takže je ovplyvnený uhlami väzieb a všeobecne molekulárnou štruktúrou.
Keď je molekula lineárna, dá sa porovnávať s dvojsekom s konceptom. Jeho negatívny koniec δ-, zodpovedal by červenej farbe; Zatiaľ čo pozitívny, δ+, bude modrá farba. Keď sa rozsah negatívnych zaťaženia zvyšuje v Δ-póle a vzdialenosť, ktorá ho oddeľuje od δ+, sa dipólový moment zvyšuje.
Chemicky vyššie uvedené znamená, že čím väčší je rozdiel v elektronegativite medzi dvoma atómami a čím dlhšia je vzdialenosť, ktorá ich oddeľuje, tým väčší je medzi nimi dipólový moment.
[TOC]
Ako sa vypočíta dipólový moment?
Považuje sa za kovalentné spojenie medzi dvoma atómami, A a B:
A-B
Vzdialenosť medzi kladným a negatívnym čiastočným zaťažením je už definovaná dĺžkou jej odkazu:
DoΔ+-BΔ-
Pretože protóny a elektróny majú rovnakú veľkosť elektrického náboja, ale s opačnými znakmi, 1.6 · 10-19C, toto je ten, ktorý sa zohľadnil pri hodnotení dipólového momentu medzi A a B prostredníctvom nasledujúcej rovnice:
Môže vám slúžiť: rozdiely medzi organickými a anorganickými zlúčeninamiμ = δ ·d
Kde μ je dipólový moment, δ je zaťaženie elektrónu bez záporného znaku a d Dĺžka spojenia vyjadreného v metroch. Napríklad za predpokladu d Má hodnotu 2 Á (1,10-10m) Dipólový moment, μA-B bude:
μA-B = (1.6 · 10-19C) · (2 · 10-10m)
= 3,2 · 10-29C · m
Ale pretože táto hodnota je veľmi malá, používa sa jednotka DeBy:
μ = (3,2,10-29C · m) · (1 d/3,33 · 10-30 C · m)
= 9,60 d
Táto hodnota μA-B by mohla predpokladať, že spojenie A-B je viac iónové ako kovalentné.
Príklady
Vodná voda
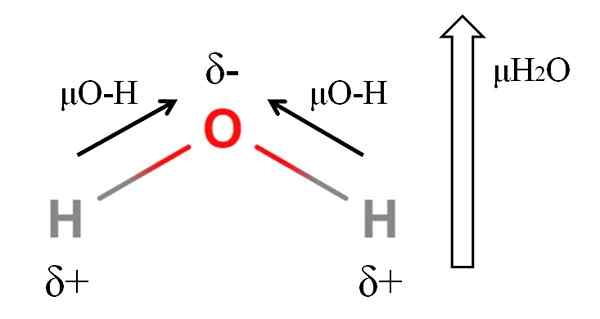 Moment dipoaru molekuly vody. Zdroj: Gabriel Bolívar.
Moment dipoaru molekuly vody. Zdroj: Gabriel Bolívar. Na výpočet dipólového momentu molekuly musíte pridať všetky dipólové momenty ich príslušných odkazov, berúc do úvahy uhly spojení a trochu trigonometrie. Toto najskôr.
Voda má jeden z najväčších dipólových momentov, ktoré by sa dali očakávať pre kovalentnú zlúčeninu. Na hornom obrázku máme, že atómy vodíka majú pozitívne čiastočné zaťaženie, δ+, zatiaľ čo kyslík nesie negatívne čiastočné zaťaženie, δ-. Odkaz O-H je dosť polárny (1.5d) a sú tu dvaja v molekule H2Ani.
Všeobecne platí, že vektor je nakreslený z menšieho elektronegatívneho atómu (H) na najviac elektronegatívny (O). Aj keď nie sú nakreslené, na atóme kyslíka existujú dva páry nezdieľaných elektrónov, ktoré „koncentrujú“ negatívnu oblasť ešte viac.
Kvôli uhlovej geometrii H2Alebo sa dipólové momenty spoja v smere atómu kyslíka. Všimnite si, že súčet dvoch μO-H by poskytol 3D (1.5+1.5); Ale nie je to tak. Dipólový moment vody má experimentálnu hodnotu 1.85d. Tu je účinok tesného uhla 105 ° medzi odkazmi H-O-H.
Môže vám slúžiť: laboratórny teplomer: Charakteristiky, čo je pre, použitie, príkladyMetanol
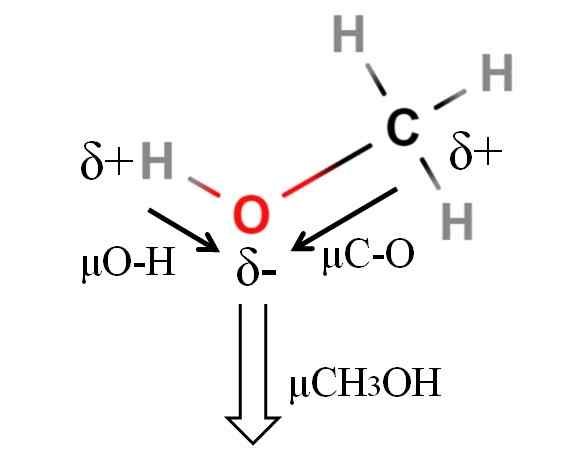 Moment dipoaru molekuly metanolu. Zdroj: Gabriel Bolívar.
Moment dipoaru molekuly metanolu. Zdroj: Gabriel Bolívar. Dipólový moment metanolu je 1.69D. Je menej ako voda. Preto atómové masy nemajú v dipólovom okamihu príliš veľký vplyv; Ale jeho atómové rádiá. V prípade metanolu nemôžeme potvrdiť, že vaše spojenie H-O má μ rovné 1.5 d; Pretože molekulárne prostredie sa v CHO líši3Ach h2Ani.
Z tohto dôvodu by sme museli zmerať dĺžku spojenia H-O v metanole, aby sme mohli vypočítať μo-H. To, čo možno potvrdiť, je, že μo-H je väčší ako μc-O.
Metanol je katalogizovaný ako jeden z najviac polárnych rozpúšťadiel, ktoré sa nachádzajú spolu s vodou a amoniakom.
Amoniak
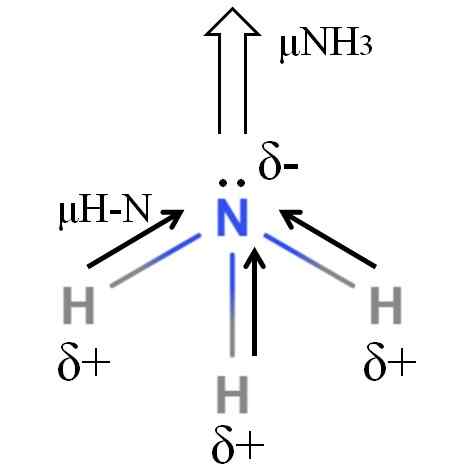 Moment dipoaru amoniakovej molekuly. Zdroj: Gabriel Bolívar.
Moment dipoaru amoniakovej molekuly. Zdroj: Gabriel Bolívar. H-n väzby sú dosť polárne, takže dusík po jeho väčšej elektronegativite priťahuje elektróny k sebe (vynikajúci obraz). Okrem toho, na ňom máme niekoľko nezapojených elektrónov, ktoré prispievajú k ich negatívnym zaťažením do oblasti A-. Preto elektrické náboje prevažujú v atóme dusíka amoniaku.
Amoniak má dipólový moment 1.42d, menej ako metanol. Keby sa amoniak aj metanol mohli transformovať na návrhy, bolo by zrejmé, že návrh metanolu má viac definovaných pólov v porovnaní s návrhu amoniaku.
Etanol
V prípade etanolu, Cho3Chvály2Ach, tvoj dipólový moment je veľmi blízko k metanolu, ale má tendenciu mať nižšie hodnoty. Mať viac atómov uhlíka tvoriaceho oblasť A+, atóm kyslíka predstavujúceho δ-, začína strácať trochu svojej „relatívnej negatívnej intenzity“.
Môže vám slúžiť: dimetylamín ((CH3) 2NH): Štruktúra, vlastnosti, použitia, rizikáOxid uhličitý
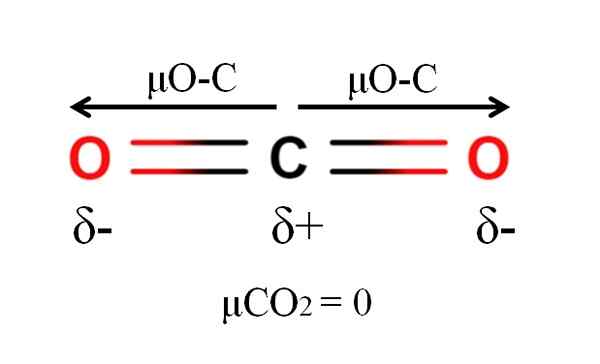 Moment dioxidu uhličitého molekuly. Zdroj: Gabriel Bolívar.
Moment dioxidu uhličitého molekuly. Zdroj: Gabriel Bolívar. Oxid uhličitý má dve polárne väzby, C = O, s príslušnými dipólovými momentmi μo-C. Ako je však vidieť na vynikajúcom obraze, lineárna geometria CO2 spôsobuje, že dve μO-C sa navzájom rušia, aj keď uhlík má kladné čiastočné zaťaženie a čiastočné zaťaženie negatívnym kyslíkom.
Z tohto dôvodu je oxid uhličitý apolárnou molekulou, pretože μco2 má hodnotu 0D.
Metán
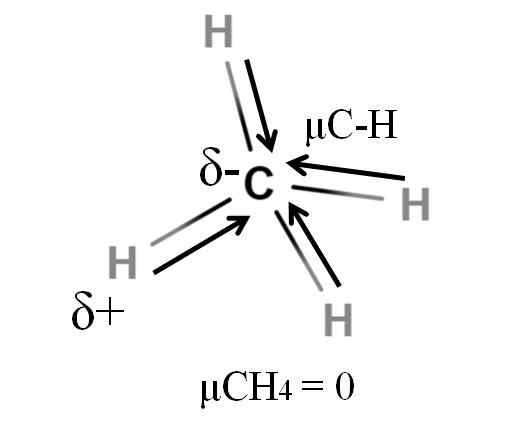 Dipolárny moment pre molekulu metánu. Zdroj: Gabriel Bolívar.
Dipolárny moment pre molekulu metánu. Zdroj: Gabriel Bolívar. Metán aj oxid uhličitý zdieľajú niečo spoločné: sú to vysoko symetrické molekuly. Všeobecne platí.
Ak uvidíme molekulu Cho4, Jeho väzby C-H sú polárne a elektróny sú smerované k atómu uhlíka, pretože sú o niečo viac elektronegatív. Dalo by sa predpokladať, že uhlík by musel byť vysoko negatívna región A; ako návrh s intenzívnym červeným centrom a jeho modrými koncami.
Keď je však CHO rozdelený4 V polovici by sme získali dve polovice H-C-H, jednu vľavo a druhú vpravo, podobne ako molekula h2Ani. Dipólový moment, ktorý je výsledkom pridania týchto dvoch μc-h, je teda zrušený s momentom druhej polovice. A preto μch4 má hodnotu 0D.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Walter J. Moore. (1963). Fyzikálna chémia. V chemickej kinetike. Štvrté vydanie, Longmans.
- Irán. Levine. (2009). Princípy fyzikálneho spôsobu. Šieste vydanie, strana 479-540. MC Graw Hill.
- HelMestine, Anne Marie, PH.D. (29. januára 2020). Definícia momentu dipólového momentu. Zotavené z: Thoughtco.com
- Blesk. (29. septembra 2019). Momenty dipól. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Larita Williams. (2020). Dipólový moment: Definícia, rovnica a príklad. Štúdium. Získané z: štúdie.com
- Wikipedia. (2020). Moment dipólu Bond. Zdroj: In.Wikipedia.orgán
- « Plynové osvetlenie, ako ho zistiť, a 5 tipov, aby sa tomu zabránilo
- Charakteristiky, funkcie, typy, príklady onomatopoeia »

