Postradučné úpravy
- 3966
- 489
- Blažej Hrmo
Čo sú post -translačné úpravy?
Post -translačné modifikácie sú reverzibilné alebo nezvratné modifikácie alebo chemické zmeny.
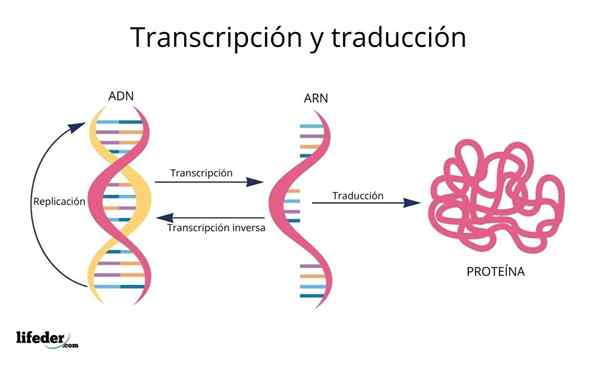
Preklad je výsledkom „čítania a interpretácie“ informácií obsiahnutých v génoch nachádzajúcich sa v eukaryotickom jadre (vyskytuje sa aj v prokaryotoch).
Génová sada bunky -genóm- Tam sú pokyny na výrobu všetkých štrukturálnych proteínov a enzýmov, ktoré sa nachádzajú v bunkovom interiéri, od ktorých závisia procesy a vitálne funkcie každej bunky.
Gény sú tvorené DNA (kyselina deoxyribonukleová), ktorá je makromolekula tvorená dvoma doplnkovými reťazcami polyméru zložených zo 4 typov rôznych molekúl nazývaných dusíka, Menovite: Adenina, Timina, Guanina a cytozín.
DNA je teda druh abeceda S informáciami, ktoré sú čítané a preložené.
Pred prekladom sú informácie v DNA ako prvé prepisovaný V jadre k inej veľmi podobnej molekule, RNA (kyselina ribonukleová), vo forme nazývaných molekuly Messenger RNA, ktoré sa neskôr prepravujú do cytosolu.
RNA je veľmi podobná DNA, ale je tvorená jediným reťazcom zloženým z adenínu, uracilu, guanínu a cytozínu dusíka.
Messenger RNA, odvodené z genetických kódujúcich proteínových sekvencií, sú následne „načítané“ a ich sekvencia je preložený v peptidových sekvenciách bunkových proteínov pomocou ribozómov a iných molekúl RNA známych ako Prenosová RNA To, ako už názov napovedá, Prenášajú sa aminokyseliny vhodné pre syntetizovaný proteín.
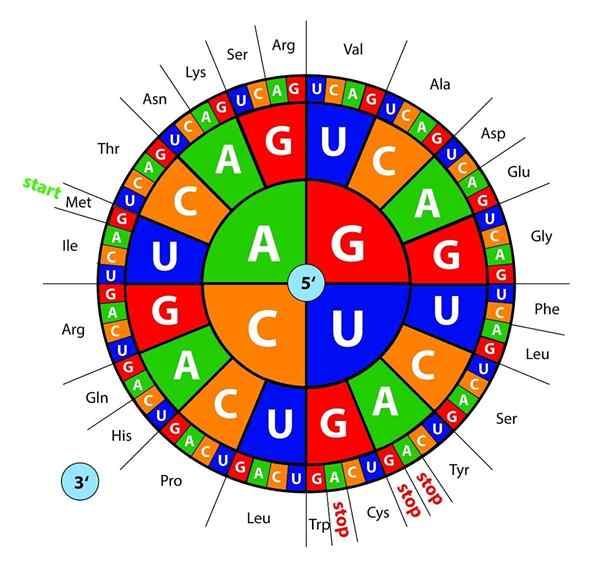
Poradie, v ktorom sa tieto aminokyseliny pridávajú do vznikajúcich proteínov.
DNA bázy, transkribované ako RNA, sú „čítané“ ribozómami v triinách alebo trojiciach nazývané kodóny, každý z nich kódovať pre jednu z 20 aminokyselín, s ktorými sa tvoria proteíny; Tu je toto genetický kód sa interpretuje tak, že v správnom poradí predstavuje aminokyselinu súčasne.
Post -translačné úpravy
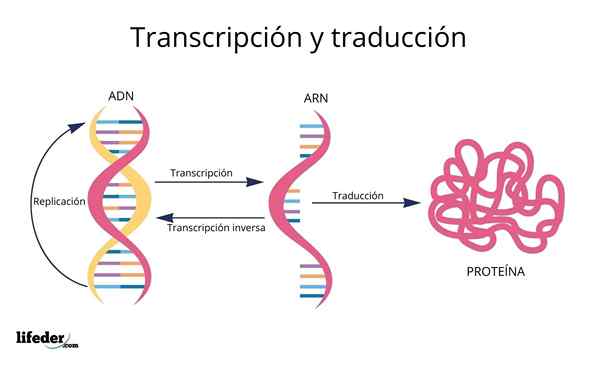
Väčšina fyzikálno -chemických a funkčných charakteristík každého proteínu závisí hlavne od informácií kódovaných v DNA.
Bunkám však dokážu významne zvýšiť diverzitu svojich proteínov prostredníctvom post -translačných modifikácií, ktoré nie sú ničím iným ako chemickými modifikáciami - sprostredkované enzýmami -, ktoré po ich translácii trpia niektorými proteínmi.
Môže vám slúžiť: oxidázová glukóza: charakteristiky, štruktúra, funkcieCharakteristiky niektorých proteínov preto nemožno odvodiť iba z aminokyselinovej sekvencie, ktorá pochádza z genetických informácií.
Tieto modifikácie sa vo všeobecnosti vyskytujú na aminokyselinovom odpade, ktoré sa.
Bolo opísaných viac ako 500 post -translačných modifikácií, ale z nich najznámejším a študovaným je fosforylácia, tvorba disulfidových mostíkov, metylácia, acetylácia, hydroxylácia, glykozylácia, prenilácia, ubiquitinácia a karboxylácia.
Proces postradácie
Post -translačné modifikácie, ako sme uviedli, sú chemické modifikácie, ktoré trpia eukaryotickými bunkovými proteínmi po ich syntéze, to znamená ich transláciu.
Všeobecne súvisia s pridaním chemických skupín a/alebo modifikáciou aminokyselinového odpadu, ktoré tvoria proteíny, ale niektoré dôležité modifikácie sa tiež týkajú vytvorenia väzieb medzi aminokyselinami toho istého proteínu alebo tiež s elimináciou aminokyselín O peptidy príznaky rezmi alebo Klimati proteolytický.
Tieto modifikácie sú možné vďaka prítomnosti určitých špecializovaných bunkových enzýmov a navyše malé energetické substráty s veľkosťou - nie sú to spontánne reakcie - napríklad: napríklad:
- ATP (adenozín 5-fosfát)
- Acetyl koenzým A (acetyl co-A)
- NAD+ (5'-nicinamid 5'-difosfátový adenozín)
- S-adenosil Metionina (SAM)
- 5'-difosfátový uracil N-Acetyl glukozamín (UDP-GrcNAc)
- Uracil 5'-glukóza difosfát (UDP-glukóza)
- Medzi inými
Niektoré z najdôležitejších post -translačných úprav pôsobia ako prepínače (Suiči) Molekulár, ktorý aktivuje alebo deaktivuje enzymatické funkcie niektorých proteínov, regulujú ich bunkovú funkciu alebo dokonca jeho intracelulárne umiestnenie.
Napríklad veľa proteínov patriacich do intracelulárnych organel je syntetizovaných v cytosóle s N-O-terminálnymi koncami, ktoré zodpovedajú Signalizačné sekvencie, ktoré sú rozpoznávané inými proteínmi zodpovednými za ich nasmerovanie do príslušného kompartmentu a na ceste sa tieto signály zvyčajne odstránia z proteínovej štruktúry.
Ďalším veľmi pozoruhodným príkladom post -translačných modifikácií, ktoré súvisia s proteolytickým klivaje, je určité hormóny a enzýmy s proteázovou aktivitou, ktoré sú syntetizované ako neaktívne proteíny, ktoré potrebujú proteolytické odstránenie niektorých svojich aminokyselín, aby sa stali ich aktívnymi formami, aby sa stali ich aktívnymi formami, aby sa stali ich aktívnymi formami, aby sa stali ich aktívnymi formami, aby sa stali ich aktívnymi formami, aby sa stali ich aktívnymi formami, aby sa stali ich aktívnymi formami.
Konjugované proteíny
Aj keď nie sú vždy vždy rozpoznané ako také, ďalšie veľmi dôležité post -translačné modifikácie sú tie, ktoré zahŕňajú tvorbu proteínov, ktorých štruktúra je zložená z jedného alebo viacerých peptidových reťazcov spojených s zlúčeninou neproteínu, buď prostredníctvom kovalentných väzieb alebo slabších interakcií a slabších interakcií a prechodný.
Všeobecne sa tieto proteíny klasifikujú podľa identity frakcie ne -proteínu a vyžadujú, aby takéto časti vykonávali svoje funkcie.
Môže vám slúžiť: krvný agarTieto frakcie alebo porcie sú známe ako Protetické skupiny A dobrým príkladom týchto proteínov je hemoglobín, ktorý je spojený so skupinou.
Endoplazmatický retikulum v akcii
Mnoho post -translačných modifikácií začína vo vnútri hrubého endoplazmatického retikula, kde pridružené ribozómy prekladajú proteíny, keď sa vkladajú do membrány tejto organely.
V endoplazmatickom retikule mnoho proteínov získava svoju konečnú štrukturálnu konformáciu: ich signálne sekvencie sa odstránia, zloží sa v správnej forme, tvoria sa disulfurové mosty, pridávajú sa sladké skupiny atď.
Typy post -translačných úprav
V eukaryotických bunkách bolo opísaných viac ako 500 typov rôznych post -translačných modifikácií; Nasledujúce zoznamy zoznamov niektoré z najviac študovaných:
-
Fosforylácia
Prenos jednej alebo viacerých fosfátových skupín z vysoko energetických molekúl, ako je ATP, smerom k aminokyselinovej hydroxylovej skupine, ako je serín, treonín a tyrozín; Je sprostredkovaný enzýmami skupiny Bielkovina mužov (Tieto fosfáty sú odstránené enzýmami fosfatázy).
Je to dôležité pri mnohých bunkových udalostiach, ako je delenie, transdukcia signálu, metabolizmus uhľohydrátov, rast buniek a postup bunkového cyklu.
-
Sulfonácia
Toto je pridanie skupiny -SO3H (sulfonicko) výlučne v odpade tyrozínovej aminokyseliny a je typické pre transmembraálne proteíny alebo proteíny, ktoré sa vylučujú. Je katalyzovaný enzýmami tyrosil-sulfotransferázy.
Je to dôležitý proces pre fungovanie mnohých membranálnych receptorov, pre určité typy intracelulárnych značiek atď.
-
Tvorba mosta medzi cysteínmi
Tento proces sa vyskytuje medzi zvyškami cysteínu a je jedným z najdôležitejších post -translačných modifikácií zo štrukturálneho hľadiska. Disulfidové mosty sú stanovené v organelách, ako je Golgiho komplex a endoplazmatické retikula, ktoré majú oxidačné prostredie.
Táto post -translačná modifikácia súvisí so vytvorením určitej štrukturálnej konfigurácie, ktorá je zvyčajne veľmi dôležitá pre aktivitu mnohých enzýmov.
-
Metylácia
Skladá sa z pridávania metylových skupín do aminokyselín, ako je lyzín, arginín, histidín, glutamín a asparagín (N-metylácia), ako je aspartát a glutamát (O-metylácia) alebo ako cysteín (S-metylácia).
Vyskytuje sa vďaka katalytickému pôsobeniu enzýmov známych ako N-, O- alebo S-metyltransferázy. Metylácia proteínu je nevyhnutná pre reguláciu genetickej transkripcie na hladine histónového proteínu, ale má tiež nižšiu úlohu pri transdukcii signálu.
-
Acetylácia
Znamená to pridanie acetylových skupín do lyzínových zvyškov niektorých proteínov. Je katalyzovaný acetyltransferázovými enzýmami a má tiež veľmi dôležité funkcie z hľadiska regulácie genetickej expresie (na úrovni histónových proteínov, ktoré sa viažu na DNA).
-
Hydroxylácia
Zvyčajne sa vyskytuje pri odpadu prolínu, lyzínu a asparagínu a je katalyzovaný enzýmami hydroxylázy závislými na železniu. Výsledné aminokyseliny, hydroxyprol a hydroxilizín sú veľmi dôležité pre dozrievanie niektorých proteínov (vrátane kolagénu) a pre niektoré antibiotické a antifungálne zlúčeniny (hydroxiaasparagín).
-
Glykozylácia
Táto modifikácia je veľmi dôležitým procesom pre eukaryotické bunky. Vyskytuje sa predovšetkým na serínovom a asparagínovom odpade, ale môže sa vyskytnúť aj na hydroxyprolínoch alebo hydroxilisínoch.
Môže vám slúžiť: Evolucionizmus: pôvod, Darwin, sociálny, lineárny a kultúrny vývojSkladá sa z pridávania sacharidových molekúl do proteínovej štruktúry a je katalyzovaný glykozyltransferázovými enzýmami a vyskytuje sa najmä v vylučovacích proteínoch a u tých, ktoré sa nachádzajú na bunkovom povrchu.
-
Prenila
Skladá sa z prenosu skupín Isaprenilos (lipid) do niektorých proteínov. Zobrazené enzýmy sú špecifické transfrázy pre každú skupinu.
Tento proces je dôležitý pre ukotvenie niektorých proteínov do bunkových membrán, ale vyskytuje sa aj počas prenosu signálu atď.
-
Ubikvitinácia
Toto je kovalentné pridanie jednej alebo niekoľkých kópií peptidu známeho ako Ubikvitín. Tento prírastok značka Na proteíny na degradáciu v proteínovom komplexe známeho ako proteozóm 26S.
Predstavuje veľmi účinný intracelulárny regulačný systém a je zodpovedný za ničenie proteínov prostredníctvom trasy závislej od ATP as účasťou troch rôznych enzýmov volaní E1, E2 a E3.
Príklady
Fosforylácia a glysilalácia sú dve mimoriadne dôležité posttranslačné modifikácie pre bunkovú životnosť. Nielen preto, že kontrolujú mnoho procesov súvisiacich s komunikáciou a bunkovým cyklom, ale aj preto, že sú medzi eukaryotami veľmi bežné.
Napríklad proteín p53 je proteín známy ako „nádorový supresor“, ktorý sa používa počas niektorých ošetrení rakoviny. Jeho aktivácia závisí od pôsobenia rôznych kinázových proteínov, ktoré sú zodpovedné za fosforyláciu svojho N-terminálneho konca.
Na druhej strane, povrch eukaryotických buniek obsahuje veľké množstvo glykoproteínov (post -translačné modifikované proteíny pridaním uhľohydrátov).
Mnohé z týchto proteínov majú okrem iného dôležité funkcie pri imunitnom rozpoznávaní, v migrácii buniek, v rozpoznávaní a spojení s receptormi.
Odkazy
- Alberts, b., Bray, D., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, P. (2015). Základná bunková biológia. Girlandská veda.
- Cox, m. M., & Nelson, D. L. (2008). Lehninger princípy biochémie. Wh Freeman.
- Garrett, R. H., & Grisham, C. M. (1999). Biochémia.
- Zelená, k. D., & Garneau-Tesodikova, s. (2010). Postranslačná modifikácia proteínov.
- Walsh, C. Tón., Garneau - -Sodikova, s., & Gatto Jr, G. J. (2005). Post -translačné modifikácie proteínov: chémia diverzifikácie proteómu. Angewandte Chemie International Edition, 44 (45), 7342-7372.