Charakteristiky atómového modelu Sommerfeld, postuláty, výhody a nevýhody
- 4442
- 296
- MUDr. Žigmund Boška
On Sommerfeld atómový model Vytvoril ho nemecký fyzik Arnold Sommerfeld v rokoch 1915 až 1916, aby vysvetlil fakty, že model Bohr, vydaný krátko predtým v roku 1913, nedokázal uspokojivo vysvetliť. Sommerfeld predstavil svoje výsledky najskôr na Bavorskej akadémii vied a potom ich uverejnil v časopise Annalen der Physik Magazine.
Model atómu navrhnutý dánskym fyzikom Niels Bohr opisuje.
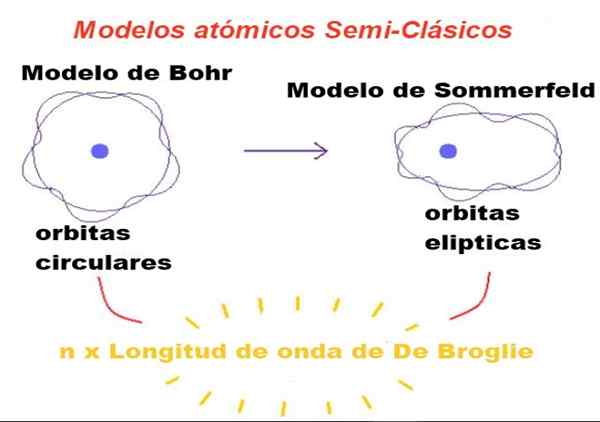
 postava 1. V semiklasických modeloch sú obežné dráhy newtonovia, ale iba tí, ktorých obvod je celé číslo, koľkokrát je povolená vlnová dĺžka Broglie. Zdroj: f. Zapata.
postava 1. V semiklasických modeloch sú obežné dráhy newtonovia, ale iba tí, ktorých obvod je celé číslo, koľkokrát je povolená vlnová dĺžka Broglie. Zdroj: f. Zapata. V teórii navrhnutej Bohr môže mať elektrón, ktorý obieha okolo jadra.
Bohr tiež uvažoval o tom, že tieto obežné dráhy boli kruhové a jedno kvantové číslo sa nazývalo hlavné kvantové číslo n = 1, 2, 3 ... slúžil na identifikáciu povolených dráh.
Prvá modifikácia zavedená Sommerfeldom modelu Bohr pozostávala z predpokladu, že elektrónová obežná dráha môže byť tiež eliptická.
Obvod je opísaný jeho polomerom, ale pre elipsu musíte dať dva parametre: semi -senije a menšie polovičné -seme, okrem toho istého priestorovej orientácie. S tým predstavil ďalšie dve kvantové čísla.
Druhou hlavnou modifikáciou, ktorú urobil Sommerfeld, bolo pridať relativistické účinky k atómovému modelu. Nie je nič rýchlejšie ako svetlo, avšak Sommerfeld našiel elektróny s výrazne zatváracou rýchlosťou, preto bolo potrebné začleniť relativistické účinky do akéhokoľvek opisu atómu.
[TOC]
Postuláty atómového modelu Sommerfeld
Elektróny sledujú kruhové a eliptické dráhy
Elektróny v atóme sledujte eliptickú obežnú dráhu (kruhové dráhy sú konkrétnym prípadom) a ich energetický stav možno charakterizovať 3 kvantovými číslami: hlavné kvantové číslo n, Sekundárne kvantové číslo alebo azimutálne číslo l a magnetické kvantové číslo mL.
Môže vám slúžiť: binárne soliNa rozdiel od obvodu má elipsa väčší polosok a menšiu polovicu.
Ale elipsy s rovnakou hlavnou semi -osou môžu mať inú menšiu polovicu, v závislosti od stupňa excentricity. Excentricita rovnajúca sa 0 zodpovedá kruhu, takže nevylučuje kruhové trajektórie. Okrem toho môžu mať elipsy vesmíru rôzne sklony.
Preto sommerfeld pridal do svojho modelu sekundárne kvantové číslo L, čo označilo menšiu polovicu a magnetické kvantové číslo mL. Poukázal teda na to, aké sú povolené priestorové orientácie eliptickej obežnej dráhy.
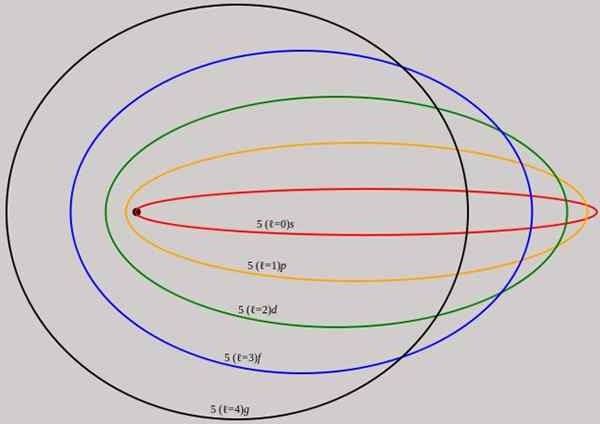 Obrázok 2. Orbity zodpovedajúce hladine energie n = 5 sú znázornené pre rôzne uhlové hybnosti L, ktoré majú úplné vlnové dĺžky de broglie. Zdroj: Wikimedia Commons.
Obrázok 2. Orbity zodpovedajúce hladine energie n = 5 sú znázornené pre rôzne uhlové hybnosti L, ktoré majú úplné vlnové dĺžky de broglie. Zdroj: Wikimedia Commons. Všimnite si, že nepridáva nové hlavné kvantové čísla, takže celková energia elektrónu na eliptickej obežnej dráhe je rovnaká ako v modeli Bohr. Preto neexistujú žiadne nové úrovne energie, ale rozvíjanie úrovní daných podľa počtu n.
Zeemanský efekt a výrazný efekt
Týmto spôsobom je možné úplne špecifikovať danú obežnú dráhu, vďaka 3 uvedeným 3 kvantovým číslom, a tak vysvetliť existenciu dvoch účinkov: Zeemanov efekt a výrazný efekt.
A tak vysvetľuje rozloženie energie, ktorá sa objavuje v normálnom Zeemanovom efekte (existuje aj anomálny Zeemanov efekt), v ktorom je spektrálna čiara rozdelená na niekoľko komponentov, keď je v prítomnosti magnetického poľa.
Toto rozloženie čiary sa vyskytuje aj v prítomnosti elektrického poľa, ktoré je známe ako Stark Effect, ktorý viedol Sommerfelda k premýšľaniu o modifikácii modelu Bohr na vysvetlenie týchto účinkov.
Atómové jadro a elektróny sa pohybujú okolo jeho hmotnostného centra
Po tom, čo Ernest Rutherford objavil atómové jadro a že skutočnosť, že takmer celá hmotnosť atómu sa tam sústreďuje, vedci verili, že jadro je viac -menej stacionárne.
Môže vám slúžiť: hydroxid lítium (LIOH)Sommerfeld však predpokladal, že jadro aj elektróny na obežnej dráhe sa pohybujú okolo hmotnostného centra systému, čo je samozrejme veľmi blízko jadra. Jeho model používa namiesto elektrónovej hmoty zníženú hmotnosť systému elektrónového jadra, namiesto elektrónovej hmoty.
Na eliptických dráhach, rovnako ako v prípade planét okolo slnka, sú chvíle, keď je elektrón bližšie, a v iných ďalej od jadra. Preto je jeho rýchlosť iná v každom bode svojej obežnej dráhy.
 Obrázok 3.- Arnold Sommerfeld. Zdroj: Wikimedia Commons. Gfhund [cc po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)].
Obrázok 3.- Arnold Sommerfeld. Zdroj: Wikimedia Commons. Gfhund [cc po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]. Elektróny môžu dosiahnuť relativistické rýchlosti
Sommerfeld zaviedol do svojho modelu konštantu jemnej štruktúry, konštanta bez rozmerov súvisiacich s elektromagnetickou silou:
a = 1/137.0359895
Je definovaný ako kvocient medzi elektrónovým zaťažením a Štvorcový vysoký a produkt medzi Planckovou konštantou h a rýchlosť svetla c Vo vákuu, všetko vynásobené 2π:
a = 2π (e2/h.c) = 1/137.0359895
Konštanta jemnej štruktúry sa týka troch najdôležitejších konštánt atómovej fyziky. Druhou je hmotnosť elektrónu, ktorý sa tu neobjaví.
Týmto spôsobom je spojený s elektrónmi s fotónmi (ktoré sa pohybujú rýchlosťou C v prázdnote), a tak vysvetľujú odchýlky niektorých spektrálnych čiary atómu vodíka predpovedí modelu Bohr modelu modelu Bohr.
Vďaka relativistickým korekciám, úrovne energie s rovnakými n Ale inak l Oddeľujú sa a vedú k štruktúre jemnej štruktúry, odtiaľ názov konštantnej α.
A všetky charakteristické dĺžky atómu možno vyjadriť z hľadiska tejto konštanty.
 Obrázok 4. Je znázornená kvantizácia uhlovej hybnosti l. Na rozdiel od kruhových obežných dráh, eliptické. Zdroj: f. Zapata.
Obrázok 4. Je znázornená kvantizácia uhlovej hybnosti l. Na rozdiel od kruhových obežných dráh, eliptické. Zdroj: f. Zapata. Výhody a nevýhody
Výhody
-Sommerfeld ukázal, že jedno kvantové číslo nebolo dostatočné na vysvetlenie spektrálnych čiary atómu vodíka.
-Bol to prvý model, ktorý navrhol priestorovú kvantizáciu, pretože projekcie dráh v smere elektromagnetického poľa sú v skutočnosti kvantifikované.
Môže vám slúžiť: Plazmový stav: Charakteristiky, typy a príklady-Model Sommerfeld uspokojivo vysvetlil, že elektróny s rovnakým hlavným kvantovým číslom N sa líšia v ich energetickom stave, pretože môžu mať rôzne kvantové čísla L a ML.
-Zaviedlo konštantnú a na vývoj jemnej štruktúry atómového spektra a vysvetlenie Zeemanského efektu.
-Zahŕňalo relativistické efekty, pretože elektróny sa môžu pohybovať s rýchlosťami pomerne blízko k svetlu.
Nevýhody
-Jeho model bol použiteľný iba na atómy s elektrónom a v mnohých ohľadoch na atómy alkalických kovov, ako je Li2+, Ale nie je to užitočné v atóme hélia, ktorý má dva elektróny.
-Nevysvetlil elektronické rozdelenie v atóme.
-Model, ktorý sa umožňuje vypočítať energie povolených štátov a frekvencie žiarenia vydaného alebo absorbovaného v prechodoch medzi stavmi, bez toho, aby poskytovali informácie o časoch týchto prechodov.
-Teraz je známe, že elektróny nedodržiavajú trajektórie s vopred určenými formami ako obežné dráhy, ale že zaberajú Orbitáli, vesmírne oblasti zodpovedajúce riešeniam Schrodingerovcov.
-Model svojvoľne kombinoval klasické aspekty s kvantovými aspektmi.
-Nepodarilo sa mu vysvetliť anomálny Zeemanov efekt, pretože to je potrebný model Dirac, ktorý neskôr pridal ďalšie kvantové číslo.
Predmety záujmu
Schrödinger atómový model.
Broglie atómový model.
Atómový model Chadwick.
Heisenberg atómový model.
Perrin atómový model.
Thomson Atomic Model.
Atómový model Dalton.
Atómový model Dirac Jordan.
Leucipo atómový model.
Bohr atómový model.
Súčasný atómový model.
Odkazy
- Mozgový. Sommerfeld atómový model a jeho nevýhody. Získané z: Brainkart.com.
- Ako sme spoznali Cosmos: Light & Matter. Sommerfeldov atóm. Zdroj: Tastargarden.co.Uk
- Parker, P. Atóm Bohr-Sommerfeld. Získané z: Physnet.orgán
- Vzdelávací roh. Sommerfeld model. Zotavené z: rinconukatívne.com.
- Wikipedia. Sommerfeld atómový model. Obnovené z: je.Wikipedia, org.

