Bohr atómový model

- 2626
- 52
- MUDr. Žigmund Boška
On Bohr atómový model Je to koncepcia dánskeho fyzika Nielsa Bohra (1885-1962) o štruktúre atómu, uverejnenej v roku 1913. V ATOM Bohr, elektróny okolo jadra zaberajú iba určité povolené dráhy, a to vďaka obmedzeniu zvaným kvantizácia.
Pre Bohr, obraz atómu ako miniatúrnej slnečnej sústavy, s elektrónmi obiehajúcim sa okolo jadra, nebol úplne v súlade so skutočnosťou, že elektrické náboje, keď sú zrýchlené, vyžarujú energiu.

Takýto atóm by nebol stabilný, pretože by sa skončil kolaps skôr alebo neskôr, pretože elektróny by sa špirálovo precipišovali do jadra. A dovtedy, pred 50 rokmi, charakteristické svetelné vzory, ktoré pri zahrievaní emitujú vodík a iné plyny.
Vzor alebo spektrum pozostáva zo série jasných čiar určitých veľmi špecifických vlnových dĺžok. A atóm vodíka sa nerozpadne emitovaním svetla.
Aby sa vysvetlil, prečo je atóm stabilný napriek tomu, že je schopný vyžarovať elektromagnetickú energiu, Bohr navrhol, že uhlová hybnosť môže prijať iba určité hodnoty, a preto aj energia. To je to, čo chápe kvantizáciou.
Akceptujete, že energia bola kvantifikovaná, elektrón by mal potrebnú stabilitu, aby sa neponáhľala smerom k jadru, ktorý ničil atóm.
A atóm vyžaruje svetelnú energiu, keď elektrón vykonáva prechod z jednej obežnej dráhy na druhú, vždy v diskrétnych množstvách. Týmto spôsobom sa vysvetľuje prítomnosť emisných vzorcov vo vodíku.
Bohr zložil týmto spôsobom víziu atómu integrujúce známe koncepty klasickej mechaniky s novoobjaveným, ako je Planckova konštanta, fotón, elektrón, atómové jadro (Rutherford bol mentorom Bohr) a vyššie uvedeným spektrom vydávania problémov.
[TOC]
Hlavné charakteristiky modelu Bohr
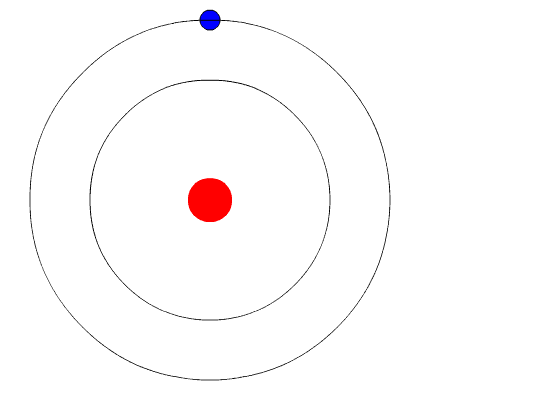 Bohr's Atom. Animácia predstavuje elektrón, keď prechádza z vyššej úrovne energie na inú z menšej energie a vydáva svetlo svetla (fotón). Zdroj: Wikimedia Commons.
Bohr's Atom. Animácia predstavuje elektrón, keď prechádza z vyššej úrovne energie na inú z menšej energie a vydáva svetlo svetla (fotón). Zdroj: Wikimedia Commons. Bohrov atómový model predpokladá, že elektrón sa pohybuje na kruhovej obežnej dráhe okolo jadra pôsobením elektrostatickej príťažlivosti Coulombu a navrhuje, aby sa kvantifikovala uhlová hybnosť elektrónu.
Môže vám slúžiť: vyváženie vektora: výpočet, príklady, cvičeniaPozrime sa, ako integrovať obe koncepty do matematickej formy:
Nech l rozsah uhlovej hybnosti, hmotnosť elektrónu a rýchlosť elektrónu a r polomer obežnej dráhy. Na výpočet L máme:
L = m kedy
Bohr navrhol, že L sa rovná celkovým násobkom konštantnej H/2π, kde H je Planck Constant, Pred krátku dobu predstavil fyzik Max Planck (1858-1947) pri riešení energetického problému emitovaného čiernym telom, teoretickým objektom, ktorý absorbuje všetky dopadajúce svetlo.
Jeho hodnota je h = 6.626 × 10-34 J ・ s, zatiaľ čo v h/2π je označený ako ħ, To znie „H bar“.
Preto uhlová hybnosť zostáva:
m⋅r⋅v = nħ, S n = 1,2, 3 ..
A z tohto stavu sú odvodené rádiá obežných dráh povolených pre elektrón, ako potom uvidíme.
Výpočet polomeru elektrónovej obežnej dráhy
V nasledujúcom texte prevezmeme najjednoduchšie atómy: vodík, ktorý pozostáva z jedného protónu a elektrónu, a to tak s veľkým zaťažením a zaťažením.
Centripetálna sila, ktorá udržuje elektrón na jeho kruhovej obežnej dráhe, je zabezpečená elektrostatickou príťažlivosťou, ktorej veľkosť f je:
F = ke2/r2
Kde k je elektrostatická konštanta Coulombu a R zákon, vzdialenosť elektrónových proteínov. Vedieť, že v kruhovom pohybe je centripetálne zrýchleniec Je daný dôvodom medzi štvorcom rýchlosti a vzdialenosti R:
doc = v2 / r
Podľa Newtonovho zákona je čistá sila produktom Mass M. zrýchlením:
Mv2/r = ke2/r2
Zjednodušenie Rádiu R sa získa:
M⋅v2R = ke2
Kombinácia tohto výrazu s výrazom uhlovej hybnosti máme systém rovníc, ktorý dal:
Môže vám slúžiť: Fyzická trajektória: Charakteristiky, typy, príklady a cvičenia1) mv2R = ke2
2) r = n ħ/mv
Cieľom je vyriešiť systém a určiť R, polomer povolenej obežnej dráhy. K odpovedi vedie malá elementárna algebra:
R = (nħ)2 / K⋅m⋅e2
S n = 1, 2, 3, 4, 5 ..
Pre n = 1 máme najmenej z rádií, nazývaných Bohr rádio aani S hodnotou 0,529 × 10-10 m. Rádiá ostatných obežných dráh sú vyjadrené z hľadiska doani.
Týmto spôsobom Bohr predstavuje hlavné kvantové číslo n, poukazuje na to, že povolené rádiá sú založené na konštante Planck, elektrostatickej konštanty a hmotnosti a zaťaženia elektrónu.
Bohr atómový model postuláty
 Dánsky fyzik Niels Bohr (1885-1962).
Dánsky fyzik Niels Bohr (1885-1962). Bohr šikovne kombinuje newtonovskú mechaniku s novými objavmi, ktoré sa neustále dávali v druhej polovici 19. storočia a začiatkom 20. storočia. Medzi nimi je revolučný koncept „koľko“, ktorého sám Plancck tvrdil, že nie je veľmi presvedčený.
Prostredníctvom svojej teórie mohol Bohr uspokojivo vysvetliť sériu vodíkového spektra a predpovedať emisie energie v hodnosti ultrafialového a infračerveného.
Vaše postuláty môžeme zhrnúť nasledovne:
Elektróny opisujú kruhové trajektórie
Elektrón sa točí okolo jadra na stabilnej kruhovej obežnej dráhe, s rovnomerným kruhovým pohybom. Pohyb je spôsobený elektrostatickou príťažlivosťou, ktorú na ňu jadro vyvíja.
Uhlová hybnosť je kvantifikovaná
Uhlová hybnosť elektrónu je kvantifikovaná podľa výrazu:
L = mvr = nħ
Kde n je celé číslo: n = 1, 2, 3, 4 ..., čo vedie k elektrónu, môže byť iba na určitých definovaných obežných dráhach, ktorých rádiá sú:
R = (n ħ)2 / k m e2
Elektróny emitujú alebo absorbujú fotóny, keď sa pohybujú z jedného energetického stavu do druhého
 Pri prechode z jedného energetického stavu do druhého elektrón absorbuje alebo vyžaruje energiu v diskrétnych množstvách nazývaných fotóny. Zdroj: Wikimedia Commons.
Pri prechode z jedného energetického stavu do druhého elektrón absorbuje alebo vyžaruje energiu v diskrétnych množstvách nazývaných fotóny. Zdroj: Wikimedia Commons. Pretože je kvantifikovaná uhlová hybnosť, energia a tiež. Dá sa preukázať, že E je daný:
Môže vám slúžiť: vertikálny záber: vzorce, rovnice, príklady
Voltový elektrón alebo EV je ďalšou jednotkou pre energiu, ktorá sa široko používa v atómovej fyzike. Negatívny znak energie zaisťuje stabilitu obežnej dráhy, čo naznačuje, že práca by sa mala vykonať na oddelení elektrónu od tejto polohy.
Zatiaľ čo elektrón je na obežnej dráhe, neabsorbuje alebo nevyjadruje svetlo. Ale keď skočí z obežnej dráhy väčšieho energie na spodnú.
Frekvencia F emitovaného svetla závisí od rozdielu medzi úrovňami energie obežných dráh:
E = hf = epočiatočný - eKonečný
Obmedzenia
Model Bohr má určité obmedzenia:
-Úspešne sa vzťahuje iba na atóm vodíka. Pokusy ho aplikovať na zložitejšie atómy nefungovali.
-Nereaguje, prečo sú niektoré obežné dráhy stabilné a iné nie. Skutočnosť, že energia v atóme bola kvantifikovaná, funguje veľmi dobre, ale model neposkytol dôvod, a to bolo niečo, čo vedcom spôsobilo nepohodlie nepohodlie.
-Ďalším dôležitým obmedzením je, že nevysvetlilo ďalšie čiary vydané atómami v prítomnosti elektromagnetických polí (Zeemanov efekt a výrazný efekt). Alebo prečo boli niektoré spektrálne línie intenzívnejšie ako iné.
-Bohr model nezohľadňuje relativistické účinky, čo je potrebné.
-Je samozrejmé, že je možné presne poznať polohu a rýchlosť elektrónu, ale skutočne sa vypočítava pravdepodobnosť, že elektrón zaberá určitú polohu.
Napriek svojim obmedzeniam mal tento model v tom čase veľký úspech, a to nielen na integráciu nových objavov s už známymi prvkami, ale preto, že vykazoval nové otázky, čo objasňuje, že cesta k uspokojivému vysvetleniu atómu bola v kvantovej mechanike.
Predmety záujmu
Schrödinger atómový model.
Broglie atómový model.
Atómový model Chadwick.
Heisenberg atómový model.
Perrin atómový model.
Thomson Atomic Model.
Atómový model Dalton.
Atómový model Dirac Jordan.
Atómový model demokritu.
Leucipo atómový model.
Sommerfeld atómový model.
Súčasný atómový model.


