Charakteristiky myozínu, štruktúra, typy a funkcia
- 2647
- 208
- Blažej Hrmo
Ten Myozín Je to molekulárny motor proteínovej povahy, ktorý je schopný pohybovať sa na aktínových vláknach v cytosóle. Energia, ktorá poháňa posun myozínu, pochádza z hydrolýzy ATP. Z tohto dôvodu je myozín zvyčajne definovaný ako mecanochemický enzým.
V eukaryotoch je myozín veľmi hojný proteín. Existujú rôzne druhy myozínu, ktoré sú kódované rodinou génov. V kvasinkách sa rozlišuje 5 tried, zatiaľ čo desiatky boli opísané u cicavcov.
 Zdroj: David Richfield (používateľ: Slashme) Pri používaní tohto obrázka v externých dielach môže byť citovaný takto: Richfield, David (2014). „Lekárska galéria Davida Richfielda“. Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]
Zdroj: David Richfield (používateľ: Slashme) Pri používaní tohto obrázka v externých dielach môže byť citovaný takto: Richfield, David (2014). „Lekárska galéria Davida Richfielda“. Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]] Myosín má širokú škálu funkcií. Myosin I, vedľa Actina, sa zúčastňuje na pohybe keratocytov.
Myozín II poskytuje stuhnutosť plazmatickej membrány, zúčastňuje sa na cytokinéze a kontrakcii svalov. Obe, myosíny I a II, spolupracujú s migráciou buniek. Myosinas I a V Vykonávajú transport vezikúl pozdĺž aktínových vlákien.
[TOC]
Štruktúra
V elektronických mikrografoch má typická štruktúra izoformy myozínu tri domény: hlava, krk a chvost. Prostredníctvom hydrolýzy s chimotripsínom sa získa segment pozostávajúci z hlavy a krku nazývaný ťažký meromiozín (HMM) a segment chvosta nazývaný svetlo meromiozín (LMM).
Majstrovstvá hlavy je N-terminálny koniec ťažkej reťazca a doména chvosta je C-terminálny koniec ľahkého reťazca.
Triedy myozínu sa dajú diferencovať počet polypeptických reťazcov, ktoré ich tvoria, a trieda hojnosti a ľahkého reťazca spojená okolo.
Myozín Mám polypeptidový reťazec, ktorý tvorí hlavu a jeho chvost nemá alfa helidálne oblasti. Zatiaľ čo myosíny I a V majú dva reťazce polypeptidov a tam.
Myosinas I a V majú miesta Únie na kalmodulín, ktorý reguluje a opravuje CA+2, V ľahkých reťazcoch. Myosina, ktorú som opravil CA+2 V ľahkých reťazcoch, ale robí to inak ako kalmodulín.
Charakteristika
Na mechanickej úrovni majú myozíny tri charakteristiky, a to:
- Hlava myozínu je motorická doména, ktorá postupuje podľa diskrétnych krokov: Únia myozínu smeruje k aktínovému vláknu, jeho sklon a následné oddelenie spôsobuje pohyb myozínu. Tento proces je cyklický a závisí od ATP.
- Zmeny konformácie: Hydrolýza molekuly ATP je spojená v každom kroku molekuly myozínu pomocou zosilnenia a prenosových hladín. To znamená veľké konformačné zmeny myozínu.
Môže vám slúžiť: radiálna symetriaPrvá úroveň amplifikácie je spôsobená stratou skupiny ATP gama-fosfátu, ktorá umožňuje reorganizáciu štrukturálnych prvkov v mieste ATP Únie ATP. Táto reorganizácia je koordinovaná so štrukturálnymi zmenami v mieste únie Actin.
Druhá úroveň zosilnenia znamená komunikáciu konformačnej zmeny v aktívnom mieste na štrukturálne komponenty terminálového karboxyl.
- Smerálnosť: Zistilo sa, že moja má polaritu alebo spätný smer, ku koncu (+) aktínového vlákna. Tento záver pochádza z experimentov s vyrovnaním aktínového vlákna s použitím fluorescenčného optického mikroskopu.
Funkcia
Myozín, vedľa aktínu, sa podieľa na kontrakcii svalov, bunkovej adhézii, cytokinéze, udeľuje tuhosť kortikálnym membránom a vytesnenie niektorých vezikúl, okrem iných funkcií.
Defekty myozínu môžu spôsobiť patologické podmienky. Napríklad defekty v myosíne I a V sú spojené s myopatiami z myozínových a pigmentačných porúch (Griselliho syndróm). Zatiaľ čo poruchy v izoformách myozínu Vi spôsobujú stratu ucha.
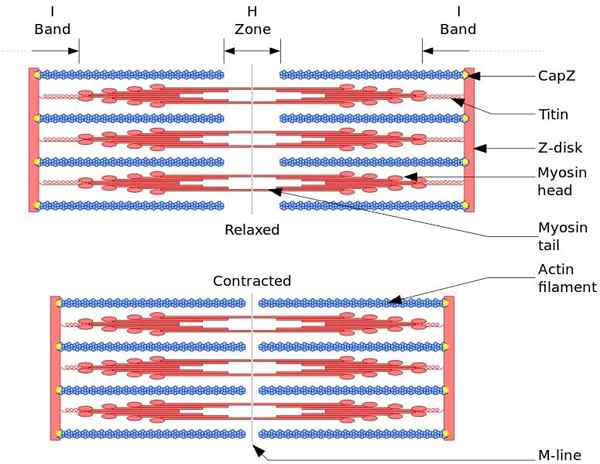
Svalová kontrakcia
Funkčná a štrukturálna jednotka kostrového svalu je sarcomro. Počas kontrakcie svalov dosiahne dĺžka sarkoméru 30% jeho pôvodnej dĺžky.
Sarkoméry sú tvorené hrubými, myozínmi a tenkými vláknami aktínu, ktoré sú organizované komplexným spôsobom. Všeobecne platí, že hlavy myozínu sa nachádzajú na distálnych koncoch vlákna a jeho chvostom smerom do stredu sarcomero a organizácia je bipolárna.
Aby sme dosiahli kontrakciu svalov, musia myozínové hlavy, opačných koncov, sa musia presunúť na Z Disk alebo do konca (+) vlákna. Pretože organizácia hrubých vlákien je bipolárna, dochádza k posúvaniu tenkých vlákien na hrubé vlákna, poháňané ATP.
Sila posunu sa vyskytuje, pretože stovky myozínových hláv, hrubého vlákna, interagujú s tenkým vláknom.
Cytocinéza
Počas mitózy, keď sú mikrotubuly pólov vretena oddelené, aktín a myozín II tvoria kontraktilný kruh v bunke bunky. Tento prsteň sťahuje jej priemer a rozdeľuje bunku na dve časti.
Udelenie tuhosti kortikálnym membránom
V mutantných bunkách, ktoré chýbajú myozín II, sa plazmatická membrána ľahko deformuje, keď sa aplikuje vonkajšia sila. Deje sa to preto, že myozín II poskytuje agregačnú silu pre proteíny plazmy membrány.
Môže vám slúžiť: morfologická adaptáciaBunková adhézia
V epitelovom tkanive sa kontraktilné lúče aktínu a myozínu II nachádzajú v štvrtiach plazmatickej membrány a tvoria kruhový pás, ktorý obklopuje povrch bunkovej bunky. Tento kruhový pás určuje tvar bunky a udržiava spojenie medzi bunkami.
K kontaktu medzi bunkami sa vyskytuje spojením kruhového pásu k molekulám adhézie buniek pomocou väzbových proteínov.
Posun niektorých vezikúl
Experimentálne dôkazy ukazujú, že myozín V vykonáva transport membrány z Golgiho aparátu do periférie buniek. Niektoré dôkazy sú:
- V bunkách nervového tkaniva imunofluorescenciou astrocytov sa zistilo, že myozín V sa nachádza vedľa Golgiho.
- V kvasinkách mutácie v géne myozínu V prerušujú sekréciu proteínu a následne sa proteíny akumulujú v cytosóle.
- Izoformy myozínu I sú zodpovedné za transport vakuol do bunkovej membrány. Použitím špecifických protilátok proti izoformám myozínu I sa zistilo, že tieto izoformy sú umiestnené v rôznych častiach bunky.
Napríklad, keď je živá améba vyznačená protilátkou proti myozínovému IC, transport vakuoly do membrány je zatknutý. Z tohto dôvodu sa vakuole rozširuje a bunka exploduje.
Choroby súvisiace s myozínom
Myosíny a strata ucha
Existuje mnoho génov a mutácií, ktoré spôsobujú stratu ucha. Toto ochorenie je často monogénne .
Mutácie v nekonvenčných myozínoch s jednou alebo dvoma hlavami myozínu ovplyvňujú fungovanie vnútorného ucha. Niektoré z mutovaných myozínových Isaformy sú myozín IIIA, myozín VIIA a myosín XVA. Nedávno boli v myozíne VI objavené dve mutácie.
Mutácie v myozíne VI sú C.897g> t a p.926q. Prvá mutácia ovplyvňuje oblasť, ktorá interaguje s aktívnym umiestneným, nazývaným prepínač I. Homozygotný na mutáciu Včasné vykazujú fenotyp, čo spôsobuje závažné účinky.
Druhá mutácia ovplyvňuje oblasť záťaže s zaťažením v vrtule alfa v chvoste myozínu VI. Táto oblasť je dôležitá pre proximálnu dimerizáciu motora a ovplyvňuje stereo-grafovú funkciu myozínu VI.
Môže vám slúžiť: pomocné vedy biológieĎalšia mutácia je P.ASN207Ser, ktorý produkuje motor, ktorý nie je schopný vytvoriť silu. Je to preto, že ASN 207 je aminokyselinový zvyšok aktívneho miesta, ktorého funkciou je spojenie a hydrolýza ATP.
Mutácia p.Arg657TRP vytvára stratu funkcie myozínu VI. Zvyšok Arg sa podieľa na konformačných zmenách, ktoré pripájajú hydrolýzu k pohybu myozínu.
Myozín X a rakovina
Myosina X (myo10) je nekonvenčný myozín, ktorý je vyjadrený v mozgu, endoteli a mnohých epiteli. Počas metastáz založených na aktíne (Philopodes, faktúry a prognózy podobné Philopodiánom) pracujú počas metastázovania rakoviny založené na aktínoch (Philopodes, faktúry a projekcie podobné Philopodiánom).
Invazívne bunky rakoviny majú veľké množstvo philopód a exprimujú vysoké hladiny fascínu. Tento proteín vykonáva pretínanie medzi aktínovými vláknami. Za účelom uniknutia z primárneho nádoru sa tvoria invaddies, bohaté na proteolytickú aktivitu, ktorá trávi okolitú extracelulárnu matricu.
Akonáhle bunky dosiahnú extracelulárnu matricu, projekcie podobné Philopodesu pomáhajú rozptýliť a kolonizovať. Vysoké hladiny myo10 naznačujú vysokú agresivitu a metastázy pri rakovine prsníka.
Myoxovo umlčanie spôsobuje stratu metastatického charakteru buniek, ktoré nie sú schopné tvoriť projekcie založené na aktíne. Všetky tieto prognózy majú porozumenie adhézií na báze, ktoré sú prepravované My1010 v rámci Philopodia.
Myox sa podieľa na formovaní centier. Absencia myox uprednostňuje tvorbu multipolárnych hrotov. Myox sa tiež podieľa na signalizácii v rakovinových bunkách. Napríklad Myox je aktivovaný 3,4,5, -inozitol trfosfát (PIP3).
Odkazy
- Alberts, b., Johnson, a., Lewis, J., a kapusta. 2007. Biológia molekulárnej bunky. Garland Science, New York.
- Brownstein, Z., Abu-rayyan, a., Karfunkel-Don, D., Sirigu, s., Davido, b., Shohat, m., Frydman, m., Houdusse, a., Kanaan, m., Avraham, K. 2014. Nové myozínové mutácie pre dedičnú stratu sluchu, ktoré sa odrážajú cieleným genomickým zachytením a masívne paralelným sekvenovaním. European Journal of Human Genetics, 22: 768 -775.
- Courson, D.Siež. a Cheney, r.A. 2015. Myozín-x a choroba. Experimentálny výskum buniek, 334: 10-15.
- Ubytovňa, h., Berk, a., Zipurski, s.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Bunková a molekulárna biológia. Redakcia Medica Panamericana, Buenos Aires, Bogota, Caracas, Madrid, Mexiko, Sāo Paulo.
- Schliwa, m. a woehlke, g. 2003. Molekulárne motory. Nature, 422: 759 - 765.
- Za to.D. 2003. Molekulárny súbor nástrojov pre intacelulárny transport. Cell, 112: 467-480.
- « Charakteristiky, štruktúra a funkcie exonukleázy
- Bromo História, štruktúra, elektronická konfigurácia, vlastnosti, použitie »

