Bromo História, štruktúra, elektronická konfigurácia, vlastnosti, použitie

- 3041
- 439
- Denis Škriniar
On bróm Je to nemetalický prvok, ktorý patrí do skupiny Halogens, skupina 17 (VIIA) periodickej tabuľky. Jeho chemický symbol je BR. Je prezentovaná ako diatomická molekula, ktorej atómy sú spojené kovalentnou väzbou, takže je priradený molekulárny vzorec2.
Na rozdiel od fluoridu a chlóru, bróm v pozemských podmienkach nie je plyn, ale červenkastá hnedá kvapalina (nižší obrázok). Fajčí a je to spolu s ortuťou, jedinými tekutými prvkami. Pod ním jód, hoci jeho farba sa zintenzívňuje a stáva sa fialovou, môže kryštalizovať v prchavej pevnej látke.
 Fľaštička s čistým tekutým brómom. Zdroj: Hi-RES obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]
Fľaštička s čistým tekutým brómom. Zdroj: Hi-RES obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)] Bromo objavil nezávisle v roku 1825 Carl Löwig, ktorý študoval pod vedením nemeckého chemika Leopolda Gmelina; Av roku 1826 francúzsky chemik Antoine-Jerome Ballard. Publikácia experimentálnych výsledkov Balard však predchádzala výsledkom Löwiga.
Bromo je 62. najhojnejším prvkom na Zemi, ktorý je distribuovaný v nízkych koncentráciách zemským kôrom. V mori je priemerná koncentrácia 65 ppm. Ľudské telo obsahuje 0,0004 % bróm, nie definitívne poznať jeho funkciu.
Tento prvok sa komerčne využíva v Salmuelas alebo na miestach, ktoré sú podľa osobitných podmienok vysoké soli; Napríklad z Mŕtveho mora, do ktorého sa konvergujú slou slanými vodami susedných území.
Je to korozívny prvok schopný útočiť na kovy, ako je platina a paladium. Bromín, ktorý je rozpustený vo vode. Pokiaľ ide o jeho toxicitu, môže spôsobiť dôležité poškodenie orgánov, ako sú pečeň, obličky, pľúca a žalúdok.
Bromín je v atmosfére veľmi škodlivý, pre ozónovú vrstvu je 40-100-krát deštruktívnejšia ako chlór. Polovica straty ozónovej vrstvy v Antarktíde je produkovaná reakciami súvisiacimi s brómmetyl, zlúčenina použitá ako fumigant.
Má početné použitia, ako napríklad: Retardér horenia, bieliace činidlo, dezinfekčný prostriedok na povrch, palivovú prísadu, sprostredkovateľ v sedatívnej výrobe, pri výrobe organických chemikálií atď.
[TOC]
História
Work Carl Löwig
Bromo objavil nezávisle a takmer súčasne Carl Jacob Löwig, nemecký chemik v roku 1825 a Antoine Balard, francúzsky chemik v roku 1826.
Carl Löwig, učeník nemeckého chemika Leopolda Gmelin, zozbieral vodu z jari zlého Kreuznacha a pridal chlór; Po pridaní éteru premiešal zmes tekutín.
Potom éter oddelený destiláciou a koncentrovaný odparením. V dôsledku toho získal červenkastú hnedú látku, ktorá bola brómom.
Práca antoine balard
Na druhej strane Balard použil popol hnedej riasy. Teda bromo uvoľňovaný chlór prešiel vodným materiálom vystaveným extrakcii, v ktorom bol prítomný bromid horečnatého, MGBR2.
Následne bol materiál destilovaný v prítomnosti oxidu mangánu a kyseliny sírovej, čo produkuje červené výpary, ktoré sa kondenzovali do tmavej kvapaliny. Balard si myslel, že to bol nový prvok a nazval ho muride, odvodený z latinského slova Muria, s ktorým bola slaná slania určená.
Môže vám slúžiť: Living Matter: Koncept, charakteristiky a príkladyBolo zdôraznené, že Balard zmenil názov Muride na Bôme na základe návrhu Anglady alebo homosexuálov Lussac, založený na skutočnosti, že Brôme znamená pestilent, ktorý definuje vôňu objaveného prvku.
Výsledky uverejnil Belard v Annales of Chemie a Physique predtým, ako Löwig publikoval svoj vlastný.
Iba od roku 1858 bol bróm vyrobený v dôležitých množstvách; Rok, v ktorom boli objavené a využívané usadeniny soli Stassfurt.
Elektronická štruktúra a konfigurácia bromo
Molekula
 Molekula BR2. Zdroj: Benjah-Bmm27 [verejná doména].
Molekula BR2. Zdroj: Benjah-Bmm27 [verejná doména]. Na hornom obrázku je znázornená molekula brómu, BR2, S kompaktným modelom plnenia. V skutočnosti existuje jednoduchá kovalentná väzba medzi dvoma atómami brómu, BR BR.
Keďže je diatomická a homogénna molekula, chýba mu trvalý dipólový moment a môže interagovať iba s ostatnými rovnakým typom prostredníctvom londýnskych disperzných síl.
To je dôvod, prečo vaša červenkastá tekutina fajčí; V molekulách BR2, Aj keď sú relatívne ťažké, ich medzimolekulárne sily ich udržiavajú slabo spojené.
Bromo je menej elektronegatívny ako chlór, a preto má nižší príťažlivý účinok na elektróny vrstiev Valencie. V dôsledku toho vyžaduje menej energie, aby cestovala vyššia hladina energie, absorbovala zelené fotóny a odrážala červenkastú farbu.
Kryštály
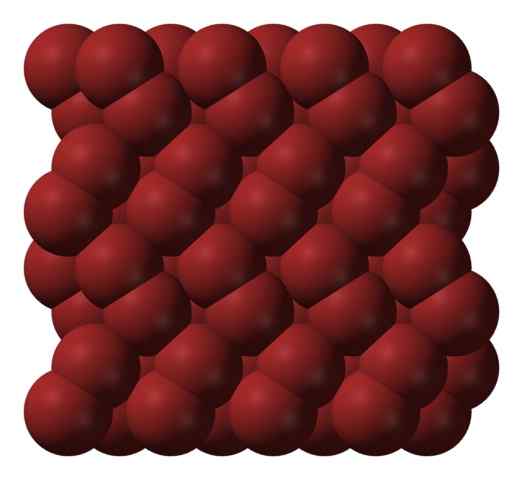 Kryštalická štruktúra Bromo. Zdroj: Ben Mills [verejná doména].
Kryštalická štruktúra Bromo. Zdroj: Ben Mills [verejná doména]. V plynnej fáze molekuly BR2 V značnej miere sa oddeľujú, až kým medzi nimi nebudú účinné interakcie. Avšak pod jeho roztavením môže byť bróm zamrznutý v červenkastých orcombických kryštáloch (vynikajúci obraz).
Všimnite si, ako BR molekuly2 Sú usporiadané tak, aby sa zdajú byť „červami brómov“. Tu a pri týchto teplotách (t < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Vrstva Valencie a stavy oxidácie
Elektronická konfigurácia brómov je:
[AR] 3D104s2 4p5
Byť 3D104s2 4p5 jeho valenčná vrstva (aj keď 3D orbitál10 Vo svojich chemických reakciách nemáte význam). Elektróny orbitálov 4S a 4p sú najvzdialenejšie a pridávajú celkom 7, iba jeden elektrón na dokončenie oktetu Valencie.
Z tejto konfigurácie sa možné oxidačné stavy odvodiť pre bróm: -1, ak elektrón získa izolektronický do Kriptonu; +1, ako 3D104s2 4p4; +3, +4 a +5, strata všetkých elektrónov orbitálu 4p ([AR] 3D104s24p0); a +7, beh bez elektrónov v orbitáli 4S ([AR] 3D104s04p0).
Vlastnosti
Fyzický vzhľad
Malá tmavo hnedá červenkasto -tekutina. Nachádza sa v prírode ako diatomická molekula, s atómami spojenými kovalentnou väzbou. Bromo je hustejšia tekutina ako voda a ponorí sa do nej.
Môže vám slúžiť: Rádio: Štruktúra, vlastnosti, použitie, získanieAtómová hmotnosť
79 904 g/mol.
Atómové číslo
35.
Vôňa
Akerový dym, dusiaci a dráždivý.
Bod topenia
-7,2 ° C.
Bod varu
58,8 ° C.
Hustota (br2)
3 1028 g/cm3
Rozpustnosť
33,6 g/l A 25 ° C. Rozpustnosť brómu vo vode je nízka a má tendenciu sa zvyšovať znížením teploty; správanie podobné iným plynom.
Rozpustnosť
Voľne rozpustný v alkoholu, éteru, chloroforme, tetrachloridu uhlíka, disulfidu uhlíka a koncentrovanej kyseliny chlorovodíkovej. Rozpustné v nepolárnych rozpúšťadlách a niektorých polárnych rozpúšťadlách, ako je alkohol, kyselina sírová a v mnohých halogénovaných rozpúšťadlá.
Trojitý bod
265,9 K pri 5,8 kPa.
Kritický bod
588 K pri 10,34 MPa.
Fúzne teplo (BR2)
10 571 kJ/mol.
Odparovacie teplo (BR2)
29,96 kj/mol.
Molárna kalorická kapacita (BR2)
75,69 kj/mol.
Tlak vodnej pary
Pri teplote 270 K, 10 kPa.
Teplota
Nie horľavý.
zapaľovač
113 ° C.
Úložisko
2 až 8 ° C.
Povrchové napätie
40,9 Mn/m A 25 ° C.
Prah
0,05 - 3,5 ppm. 0,39 mg/m3
Index lom (ηd)
1 6083 až 20 ° C a 1 6478 až 25 ° C.
Elektronegativita
2.96 v Pauling Scale.
Ionizačná energia
- Prvá úroveň: 1.139,9 kj/mol.
- Druhá úroveň: 2.103 kJ/mol.
- Tretia úroveň: 3.470 kJ/mol.
Atómové rádio
120 hod.
Kovalentný rádio
120,3 hod.
Van der Waals Radio
185 hod.
Reaktivita
Je menej reaktívny ako chlór, ale reaktívnejší ako jód. Je to oxidant menej silný ako chlór a silnejší ako jód. Je to tiež slabšie redukčné činidlo ako jód, ale silnejší ako chlór.
Chlórová para je vysoko korozívna pre mnoho materiálov a ľudských tkanív. Útočí na mnoho kovových prvkov vrátane platiny a paladium; Ale neútočí olovo, nikel, horčík, železo, zinok a do 300 ° C, buď k sodíku.
Bromo vo vode prežíva zmenu a transformuje sa na bromid. Môže tiež existovať ako bróm (brácho3-), V závislosti od kvapalného pH.
V dôsledku oxidačného pôsobenia môže bróm vyvolať uvoľňovanie radikálov bez kyslíka. Jedná sa o silné oxidanty a môžu spôsobiť poškodenie tkaniva. Bromín tiež môže produkovať spontánne zapaľovanie v kombinácii s draslíkom, fosforom alebo cínom.
Žiadosti
Benzínové prísady
Na odstránenie možných ložísk olova v automobiloch sa použil etyléndibromid. Po spaľovaní benzínu, ktorý používal olovo ako prísadu, bróm kombinovaný s olovom k vytvoreniu oloveného bromidu, prchavého plynu, ktorý bol vylúčený výfukovou trubicou.
Zatiaľ čo bróm eliminoval olovo z benzínu, jeho deštruktívna činnosť na ozónovej vrstve bola veľmi silná, a preto bola pre túto aplikáciu vyradená.
Pesticídy
Metylén alebo bromometylbromid sa použil ako pesticíd na čistenie pôdy, najmä na odstránenie parazitických nematód, ako napríklad anylostome.
Použitie väčšiny zlúčenín obsahujúcich bróm bolo však opäť deštruktívne na ozónovej vrstve.
Ortuťová kontrola
Bromo sa používa v niektorých rastlinách na zníženie emisie ortuti, veľmi toxický kov.
Môže vám slúžiť: gravimetria: gravimetrická analýza, metódy, použitia a príkladyFotografia
Bromid striebra, okrem strieborného yoduro a chloridu striebra, sa používa ako zlúčenina citlivou na svetlo vo fotografických emulziách.
Terapeutické akcie
Bromid draselného, ako aj lítiumbromid, sa používali ako všeobecné sedatíva v 19. storočí a na začiatku dvadsiateho storočia. V niektorých krajinách sa stále používajú jednoduché soli.
FDA Spojených štátov však neschváli použitie brómu na liečbu akejkoľvek choroby dnes.
Retardér ohňa
Bromín sa transformuje plameňmi na kyselinu bromhotovú, ktorá interferuje s oxidačnou reakciou, ktorá sa vyskytuje počas požiaru, a vytvára jeho vyhynutie. Polyméry obsahujú brómy, ktoré sa používajú na výrobu živíc spomaľujúcich oheň.
Aditívna potravina
Bromáty draselného bromátu boli pridané na múku na zlepšenie jej varenia.
Chemické činidlá a sprostredkovateľ
Vodíkový bromid sa používa ako redukčné činidlo a katalyzátor organických reakcií. Bromo sa používa ako chemický sprostredkovateľ pri výrobe liečiv, hydraulických tekutín, činidiel chladiva, odvlhčovacích prostriedkov a prípravkov na zvlnenie vlasov.
Nájde tiež použitie pri vypracovaní dobre vŕtacích tekutín, výrobkov na dezinfekciu vody, belavých látok, povrchových dezinfekčných prostriedkov, farbív, palivových prísad atď.
Biologické pôsobenie
Štúdia uskutočnená v roku 2014 naznačuje, že bróm je nevyhnutným kofaktorom na biosyntézu kolagénu IV, čo robí bróm základným prvkom pre vývoj tkaniva živočíšnych tkanív. Neexistujú však informácie o dôsledkoch deficitu prvku.
Kde sa to nachádza
Bromo je komerčne extrahovaný zo soľných baní a hlbokých Salmuelas Wells nachádzajúcich sa v štáte Arkansas a vo Veľkom slanom jazere v Utahu, obidve v Spojených štátoch. Táto posledná soľanka má koncentráciu 0,5 % brómov.
Na extrahovanie brómu.
Mŕtve more na hranici medzi Jordánskom a Izraelom je uzavreté more, ktoré je pod hladinou mora, čo z neho robí veľmi vysokú koncentráciu solí.
Bromo a Potassa sa tam komerčne získajú odparovaním vody s vysokou soľou Mŕtveho mora. V tomto mori môže koncentrácia brómu dosiahnuť 5 g/l.
Nachádza sa tiež vo vysokých koncentráciách v niektorých horúcich prameňoch. Napríklad Bominita je minerál strieborného bromidu nachádzajúci sa v Bolívii a Mexiku.
Riziká
Bromín v kvapalnom stave je korozívny pre ľudské tkanivá. Ale najväčšie nebezpečenstvo pre človeka pochádza z bromínových parov a vdýchnutia.
Dýchajte v prostredí s koncentráciou brómov 11-23 mg/m3 Vytvára vážne šoky. Koncentrácia 30-60 mg/m3 Je to mimoriadne škodlivé. Medzitým môže byť koncentrácia 200 mg smrteľná.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Národné centrum pre biotechnologické informácie. (2019). Bróm. Databáza pubchem. CID = 23968. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Ross Rachel. (8. februára 2017). Fakty o bróme. Zotavené z: Livescience.com
- Wikipedia. (2019). Box. Zdroj: In.Wikipedia.orgán
- Šošovica B. Vložka. (2019). Bróm. Získané z: Lentech.com
- « Charakteristiky myozínu, štruktúra, typy a funkcia
- Charakteristiky nukleas, štruktúra, typy a funkcie »

