Alkalineter
- 4373
- 1375
- Adrián Fajnor
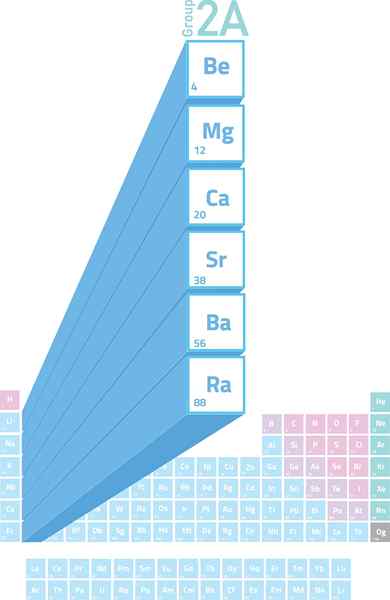
 Umiestnenie alkalinoterróznych kovov v periodickej tabuľke
Umiestnenie alkalinoterróznych kovov v periodickej tabuľke Čo sú zásadne kovy?
Ten Alkalineter Sú prvkami skupiny 2 (predtým nazývaná skupina 2A) periodickej tabuľky. To znamená, že sú tvorené 6 prvkami druhého stĺpca periodickej tabuľky od Berylia (BE) po rádio (RA).
Sú skupinou celkom reaktívnych a relatívne bežných kovových prvkov. Majú iba dva valenčné elektróny umiestnené v orbitáli S. Z tohto dôvodu patria do bloku S periodická tabuľka.
Názov „alkalinoterreo“ pochádza z spojenia „alkalických“ slov, čo je ďalší spôsob, ako povedať základné a Zem, čo bolo povedané pred oxidmi. Takže alkalinoterrózne kovy doslova znamenajú kovy, ktoré tvoria základné oxidy.
Tieto kovy majú veľa aplikácií, ktoré ich robia dôležitými v našej súčasnej spoločnosti, najmä horčíka. Tieto aplikácie sú spôsobené ich konkrétnymi vlastnosťami, ktoré sú opísané nižšie.
Vlastnosti alkalinoterróznych kovov
Majú kovový vzhľad
Všetky alkalinoterrózne kovy majú striebornú farbu s kovovým jasom. Radón je tiež rádioaktívny, takže svieti v tme emitujúcom charakteristické zelené svetlo.
Sú to malé husté kovy
Všetky alkalothrous kovy sú hustejšie ako voda, ale sú menej husté ako väčšina ostatných kovových prvkov v periodickej tabuľke.
Hustoty v tejto skupine sa pohybujú od 1,54 g/cm3 Pre vápnik do 5,5 g/cm3 Pre rádio, ktoré je podstatne menšie ako hustota iných kovov, ako je železo (7,9 g/cm3), meď (9,0 g/cm3), olovo (11,3 g/cm3) a El Mercurio (13,5 g/cm3), vymenovať zopár.
Majú relatívne nízke body topenia a varu
Byť kovov, jeho topiace sa a varné body sú väčšie ako body väčšiny ne -metálov. Sú však nižšie ako body fúzie a varu väčšiny ostatných kovov, až na niektoré výnimky.
Môže vám slúžiť: Arrheniusova rovnicaMajú Valencia +2
Vďaka svojej elektronickej konfigurácii majú tieto kovy tendenciu strácať dva elektróny, keď reagujú s inými prvkami, ako sú napríklad ne -metaly. Z tohto dôvodu je jeho jediný Valencia +2.
Sú relatívne reaktívne
Alkalinoterrózne kovy sú oveľa reaktívnejšie ako kovy, ako je železo alebo meď, ale sú menej reaktívne ako alkalické kovy (prvky skupiny 1). Čím nižšia je skupina, tým reaktívnejší je kov.
Napríklad berylium (prvá zo skupiny) nereaguje s vodou, zatiaľ čo nasledujúce dve môžu reagovať s horúcou vodou a posledné môžu dokonca reagovať so studenou vodou.
Reagujte so vzduchom a vytvára základné oxidy
Tieto kovy majú tendenciu tvoriť základné oxidy, keď reagujú s kyslíkom vzduchu. V skutočnosti sa preto nazývajú alkalinery. Tieto oxidy, keď sa rozpúšťajú vo vode, sa stávajú hydroxidmi, ktoré produkujú alkalické alebo základné roztoky.
Alkalinoterrózne kovové aplikácie
V technologickom priemysle
Niektoré z alkalinoterróznych kovov sa používajú vo výrobe polovodičov. Sú nevyhnutné pri výstavbe elektronických obvodov, ako sú tie, ktoré obsahujú prakticky všetky moderné elektrické spotrebiče, od počítačov a mobilných telefónov, až po práčky, autá a ďalšie.
V potravinárskom priemysle
Vápnik je nevyhnutnou živinou pre život. Je súčasťou štruktúry kostí a má v tele ďalšie dôležité funkcie. Z tohto dôvodu sa tento prvok pridáva ako objemca mnohých potravín od obilnín po mliečne výrobky. Okrem toho sa používa aj vo výrobe syrov.
Môže vám slúžiť: Circonium: História, vlastnosti, štruktúra, riziká, použitieV automobilovom priemysle
Niektoré z alkalinoterróznych kovov majú veľmi dobré mechanické vlastnosti, čo znamená, že sú tvrdé a odolné. Okrem toho sú odolné proti korózii, takže sa často používajú pri výrobe luxusných kolies pre autá, ako aj ďalšie časti z nich.
Vo vojenskom priemysle
Vďaka svojim mechanickým vlastnostiam a nízkej hustote sa na konštrukciu bojových lietadiel, satelitov a vrtuľníkov používajú kovy ako horčík a berylia.
Okrem toho sa vďaka svojim elektrickým vlastnostiam používajú aj na výrobu rôznych typov senzorov a optických a elektronických systémov, ktoré vojenský priemysel používa na vytváranie zbraní a komunikačných systémov.
Šesť alkalických kovov
Existuje iba šesť alkalických kovov. Ďalej existuje stručný popis každého z nich:
Berylium (be)
Je to prvok číslo 4 periodickej tabuľky a prvá zo skupiny alkalinoterróznych kovov. Je to veľmi ľahký, silný kov s jedinečnými vlastnosťami, vďaka ktorým je užitočný pri výrobe polovodičov.
Horčík (mg)
Horčík je relatívne svetlý strieborný kov s nízkym roztavením a bodom varu (v porovnaní s inými kovmi). Je veľmi tvrdý a odolný a často sa používa pri výrobe častí automobilov a ako prísadka pri príprave zliatiny, ako sú určité typy ocele.
Je to druhý alkalský kov a číslo prvku 12 periodickej tabuľky. Rovnako ako iné prvky v tejto skupine, je to nevyhnutná živina pre život.
Vápnik (CA)
Vápnik je 5. najhojnejším prvkom v zemskej kôre. Nachádza sa ako uhličitan vápenatý v mnohých mineráloch a horninách a je tiež nevyhnutným prvkom pre život kvôli jeho účasti na tvorbe kostí a jeho významom v nervovom systéme.
Môže vám slúžiť: chlorid strontium (SRCL2)Tento kov je prvok číslo 20 periodickej tabuľky, je vo štvrtom období a je tretím alkalovým kovom.
Strontium (SR)
Číslo prvku 38 a štvrtý alkalický kov je strontium. Je ťažší ako vápnik, ale zdá sa to veľa z hľadiska chemických a fyzikálnych vlastností. V skutočnosti môže stroncium nahradiť vápnik v kostiach.
Toto je obzvlášť problematické, keď sa vystavujeme rádioaktívnemu strontiu, ktoré sa vyskytuje po jadrovej reakcii, pretože pri dodržiavaní kostí je veľmi ťažké vylúčiť z tela a otráviť nás ožarovaním trochu.
Bária (BA)
Tento prvok má atómové číslo 56 a má tiež vlastnosti celkom podobné vlastnostiam vápnika a stroncia. Je to dosť mäkký a veľmi reaktívny kov, ktorý nie je v podstate elementárny. Je to jeden z alkalinoterróznych kovov s väčším kovovým charakterom.
Rádio (RA)
Posledným prvkom skupiny Alcalinoterreos je rádio, rádioaktívny kov (odtiaľ názov), ktorý vyžaruje slabé zelené svetlo, ktoré sa dá ľahko pozorovať v tme.
Pri príprave obrazov, ktoré žiaria v tme, sa veľa používalo.

