Meniscus (chémia)
- 1953
- 292
- Valentín Dula
 Konkávny a konvexný meniskus. Zdroj: Wikimedia Commons
Konkávny a konvexný meniskus. Zdroj: Wikimedia Commons Čo je menisku (chémia)?
On menisku Je to zakrivenie povrchu kvapaliny. Je to tiež voľný povrch kvapaliny v rozhraní kvapalného vzduchu. Kvapaliny sa vyznačujú tým, že majú pevný objem, ktorý je nekomprimovaný.
Tvar tekutín sa však líši, keď prijíma tvar nádoby, ktorý ich obsahuje. Táto charakteristika je spôsobená náhodným pohybom molekúl, ktoré ich tvoria.
Kvapaliny majú schopnosť prúdiť, vysokú hustotu a rýchlo sa šíriť v iných tekutinách, s ktorými sú miešateľné.
Zaberajú najnižšiu plochu nádob. Za určitých okolností môžu prijať špeciálne formy, ako sú kvapky, bubliny a bubliny.
Vlastnosti kvapalín, ako je bod topenia, tlak pary, viskozita a teplo odparovania, závisia od intenzity intermolekulárnych síl, ktoré dávajú súdržnosť kvapalinám.
Kvapaliny však tiež interagujú s nádobou prostredníctvom adhéznych síl.
Meniskus potom vyplýva z týchto fyzikálnych javov: rozdiel medzi kohéznymi silami medzi kvapalnými časticami a adhéziou, čo im umožňuje navlhčiť steny.
Čo je to menisku?
Ako je vysvetlené, menisku je výsledkom niekoľkých fyzikálnych javov, medzi ktorými je možné spomenúť aj povrchové napätie kvapaliny.
Súdržné sily
Súdržné sily je fyzický pojem, ktorý vysvetľuje intermolekulárne interakcie v kvapaline. V prípade vody sú súdržné sily spôsobené interakciou dipólu-dipolo a vodíkovým mostom.
Môže vám slúžiť: oxid chlóru (iii): Vlastnosti, štruktúra, použitieMolekula vody je bipolárna povaha. Dôvodom je, že kyslík molekuly je elektronegatívny, pretože má väčšiu aviditu v dôsledku elektrónov ako hydrogény, čo určuje, že kyslík zostáva so záporným zaťažením a vodíny sú pozitívne nabité.
Medzi negatívnym zaťažením molekuly vody, ktorá sa nachádza v kyslíku, existuje elektrostatická príťažlivosť a pozitívne zaťaženie inej molekuly vody, ktorá sa nachádza v hydrogénoch.
Táto interakcia je to, čo vie ako interakcia alebo sila dipólových dipólov, čo prispieva k kohézii tekutín.
Adhézne sily
Na druhej strane molekuly vody môžu interagovať so sklenenými stenami čiastočným zaťažením atómov vodíka molekúl vody, ktoré viažu atómy kyslíka povrchu skla skla v atómoch kyslíka.
To predstavuje adhéznu silu medzi tekutinou a tuhou stenou, čo hovorovo znamená, že tekutina zvíťazí stenu.
Keď sa na sklenený povrch umiestni silikónový roztok, voda úplne nepodarí sklo, ale na tieto kvapky, ktoré sa dajú ľahko eliminovať.
Je teda uvedené, že pri tomto ošetrení sa priľnavosť medzi vodou a sklom zníži.
Veľmi podobný prípad sa vyskytuje, keď sú ruky mastné a pri ich umývaní vodou je možné na pokožku vidieť veľmi definované kvapky namiesto navlhčenej pokožky.
Typy meniskov
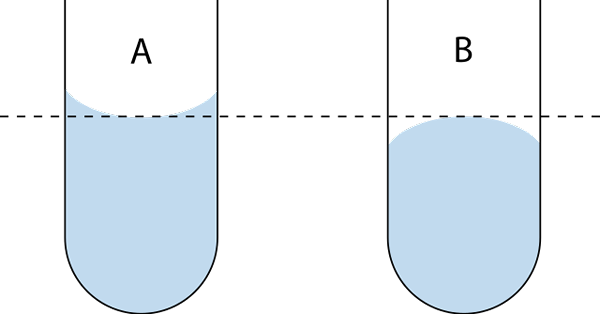
Existujú dva typy menisku: konkávne a konvexné. Na vynikajúcom obrázku je konkávna A a konvex B. Bodkované čiary označujú správne splachovanie pri čítaní objemu.
Môže vám slúžiť: neutrálny atómKonkávny menisku
 Konkávne opatrenia. Zdroj: Wikimedia Commons
Konkávne opatrenia. Zdroj: Wikimedia Commons Konkávny menisku je charakterizovaný tým, že kontaktný uhol 9, ktorý tvorí stenu skla s dotyčnou čiarou k menisku, ktorý sa zavádza do lona kvapaliny, má hodnotu menšiu ako 90 ° °.
Ak je na sklo umiestnené množstvo tekutiny, má tendenciu sa šíriť na sklenenom povrchu.
Prítomnosť konkávneho menisku.
Preto tekuté kúpanie alebo naliehané sklenenú stenu, zachovanie množstva tekutiny a dáva menisku konkávne konkávne. Voda je príkladom tekutiny, ktorá tvorí konkávny meniskus.
Konvexný menisku
V prípade konvexného menisku má kontaktný uhol 9 hodnotu vyššiu ako 90 °. Ortuť je príkladom tekutiny, ktorá tvorí konvexnú menisku. Ak sa na sklenený povrch umiestni kvapka ortuti, má kontaktný uhol 9 hodnotu 140 °.
Pozorovanie konvexného menisku. Hovorí sa, že tekut.
Povrchové sily súdržnosti (kvapalina-kvapalina) a adhézia (kvapalné pevný) sú zodpovedné za mnoho javov biologického záujmu, ako je napríklad prípad povrchového napätia a kapilarita.
Povrchové napätie
Povrchové napätie je čistá príťažlivosť sily vyvíjaná na molekuly tekutí.
Môže vám slúžiť: diatomické prvkyPreto povrchové napätie má tendenciu súdiť tekutinu a dáva viac konkávneho menisku. Inými slovami, táto sila má tendenciu odstraňovať povrch sklenenej steny tekutiny.
Povrchové napätie má tendenciu klesať so zvyšujúcim sa teplotou: napätie povrchovej vody sa rovná 0,076 N/m 0 ° C a 0,059 N/m A 100 ° C.
Zatiaľ čo povrchové napätie ortuti pri 20 ° C je 0,465 N/m. To by vysvetlilo, prečo ortuťové formy konvexujú menisku.
Kapitarita
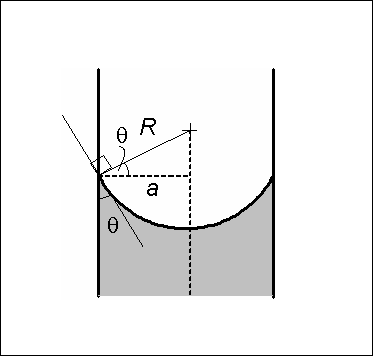
Ak je kontaktný uhol 9 menší ako 90 ° a kvapalná zvrhla sklenená stena, tekutina vo vnútri sklenených kapilár môže vystúpiť, až kým nedosiahne rovnováhu.
Hmotnosť kvapalného stĺpca je kompenzovaná vertikálnou zložkou kohéznej sily v dôsledku povrchového napätia. Adhézna sila nezasahuje, pretože je kolmá na povrch trubice.
Tento zákon nevysvetľuje, ako môže voda vystúpiť z koreňov na listy cez xylemové cievy.
V skutočnosti sú v tomto ohľade zapojené ďalšie faktory, napríklad: keď sa voda v listoch odparuje, umožňuje, aby sa molekuly vody v hornej časti kapilár.
To umožňuje ďalšie molekuly na spodku kapilár, aby vystúpili, aby zaberali miesto odparovaných molekúl vody.
Odkazy
- Whitten, Davis, Peck & Stanley. Chémia. Učenie sa.
- HelMestine, Anne Marie, PH.D. Ako čítať menisku v chémii. Zotavené z Thoughtco.com

