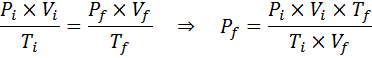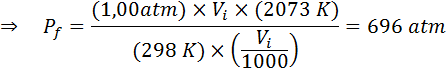Zákon o všeobecných plynoch

- 4795
- 1443
- MUDr. Žigmund Boška
Aký je všeobecný zákon o plyne?
Ten Zákon o všeobecných plynoch, Niekedy sa nazýva aj kombinovaný zákon plynov. Je to zákon, ktorý opisuje vzťah medzi tlakom, teplotou a objemom pevného množstva ideálneho plynu.
Vyhlásenie tohto zákona hovorí:
„Ak je počet mólov plynu konštantný, vzťah medzi tlakovým objemom a teplotným produktom zostáva konštantný.„
V matematickej podobe je všeobecný zákon plynov vyjadrený takto:
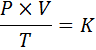
Kde p predstavuje tlak plynu, v jeho objem, t jeho absolútna teplota a k je konštanta proporcionality, ktorej hodnota závisí od množstva súčasného plynu, ako aj od jednotiek, v ktorých sú vyjadrované ostatné premenné.
Alternatívne formy všeobecného práva na plyn
Ako zákon o proporcionalite
Alternatívny spôsob vynájdenia všeobecného zákona o plynoch je vo forme zákona proporcionality:
„Pre akékoľvek pevné množstvo plynu je produkt jeho tlaku a jeho objemu priamo úmerný teplote“.
To znamená, že:
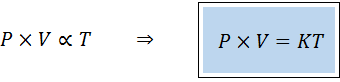
To je ekvivalentné vynásobeniu oboch členov prvej rovnice teplotou.
Vzťah medzi počiatočným a konečným stavom
Rovnako ako zákony Boyle, Charles a Gay-Lussac, aj všeobecný zákon o plynu sa môže vyjadriť ako vzťah medzi pôvodným štátom a konečným stavom plynu, ktorý prechádza zmenou štátu.
Na rozdiel od predchádzajúcich zákonov nie je potrebné, aby žiadna z týchto troch premenných zostala konštantná, iba počet mólov. To znamená, že pomer PXV/T bude rovnaký v počiatočnom stave, Jo, A v konečnom stave, F. Inými slovami, všeobecný zákon o plyne možno matematicky vyjadriť ako:
Môže vám slúžiť: kyselina píchrová: čo je, štruktúra, syntéza, vlastnosti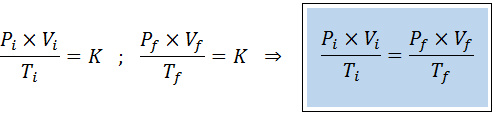
Odvodenie vzorca všeobecného zákona o plyne
Ako je uvedené vyššie, zákon o všeobecnom plyne pochádza z kombinácie zákonov Boyle, Charlesa a Gay-Lussac. Tieto zákony sú uvedené nižšie:
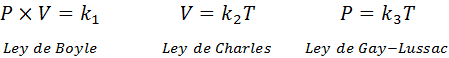
Ak z každého z týchto zákonov vyčistíme konštantu klimatizovať, A potom ich vynásobíme navzájom, dostaneme:
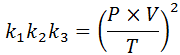
Teraz, keď vezmeme druhý koreň v oboch členoch, získa sa všeobecný zákon o plyne:
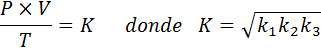
Všeobecný zákon o plynoch vs. Zákon ideálnych plynov
Zákon o všeobecných plynoch s zákonom ideálnych plynov by sa nemal zamieňať. Napriek tomu, že sú dva veľmi podobné a tiež úzko súvisiace zákony, všeobecný zákon o plyne kombinuje iba zákony Boyle, Charlesa a Gay-Lussac.
Zákon o ideálnych plynároch dodáva princíp Avogadro, podľa ktorého “Rovnaké objemy rôznych plynov meraných za rovnakých podmienok teploty a tlaku obsahujú rovnaký počet častíc “.
V dôsledku toho okrem vzťahu teploty, objemu a tlaku umožňuje aj tento premenný súvisieť s počtom častíc alebo mólov plynu, takže predstavuje štátnu rovnicu stavu stavu Ideálne plyny.
V nasledujúcich rovniciach je možné ľahšie pozorovať rozdiel medzi týmito dvoma zákonmi:

Všimnite si, že hlavný rozdiel medzi obom n, ktorý predstavuje počet mólov a tiež namiesto konštanty K, má Konštanta R, ktorá je konštantou ideálnych plynov.
Môže vám slúžiť: terpenosDalo by sa povedať, že zákon ideálnych plynov je všeobecnejší ako všeobecný zákon o plyne, pretože ho možno uplatniť na akékoľvek množstvo plynu pri akomkoľvek súbore podmienok tlaku, teploty a objemu. Na druhej strane uplatňovanie všeobecného zákona o plyne vyžaduje, aby množstvo plynu zostalo konštantné.
Príklady uplatňovania všeobecného práva na plyn
Nižšie sú uvedené príklady typických problémov, v ktorých je možné uplatniť všeobecný zákon o plyne:
Príklad 1: Bublina pod vodou
Predpokladajme, že potápač, ktorý je v hĺbke 20 m pod vodou, kde je tlak 3,00 atm a teplota je 15 ° C uvoľňuje dych vzduchu a jeden z bublín má počiatočný objem 100 cm3.
Stanovte objem vzduchovej bubliny, keď dosiahne povrch, ktorý je v štandardných podmienkach teploty a tlaku, za predpokladu, že množstvo vzduchu vo vnútri bubliny sa nemení, keď stúpa.
Riešenie
Najprv musíme extrahovať všetky údaje z príkazu. Rozumie sa, že existujú dva rôzne stavy pre plyn, jeden počiatočný a jeden koniec, takže údaje rozdelíme na dve skupiny. Je tiež potrebné previesť teploty pri absolútnej teplote:

Keďže problém uvádza, že nedochádza k zmene množstva plynu (vzduch), potom môžeme uplatniť všeobecný zákon o plyne, z ktorého môžeme vyčistiť konečný objem:
Môže vám slúžiť: Rodio: História, vlastnosti, štruktúra, použitie, riziko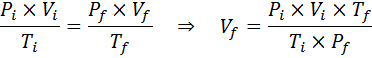
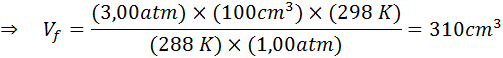
Preto vzduchová bublina dosahuje objem 310 cm3 Po dosiahnutí povrchu.
Príklad 2: Vysoký tlak
Koľko bude tlak ideálneho plynu, ktorý je pri teplote okolia 25 ° C a tlak 1,00 atm a stlačí tisícinu jeho objemu súčasne zahrievanie na 1800 ° C v utesnenej nádobe?
Riešenie
Ako predtým, začneme extrahovaním údajov:

Ako sa uvádza, že tento proces sa vykonáva v zapečatenej nádobe, potom sa množstvo plynu nemení, takže je možné uplatniť všeobecný zákon o plyne: