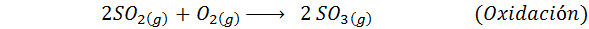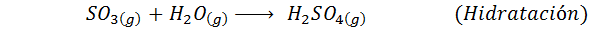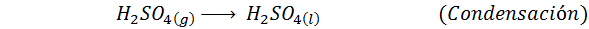Kyselina sírová (H2SO4)

- 4244
- 1147
- Tomáš Mydlo
Vysvetľujeme, čo je kyselina sírová, jej chemická štruktúra, vlastnosti, ako sa získa, aplikácie a riziká použitia sú
 Lode kyseliny sírovej (H2SO4)
Lode kyseliny sírovej (H2SO4) Čo je kyselina sírová?
On kyselina sírová, Nazýva sa tiež síran vodíkom a vitriolový olej a je kyselinou kyselinou oxacidou tvorenou reakciou sulfurského anhydridu (tak3) a voda. Jeho molekulárny vzorec je H2SW4 A je to zďaleka najprodukovanejšia a najpoužívanejšia minerálna kyselina.
Je to silná a vysoko korozívna minerálna kyselina, ktorá je miešateľná s vodou, takže sa dá pripraviť vo forme roztokov takmer akejkoľvek koncentrácie medzi 0 a okolo 18 molárnych.
Vysoké objemy výroby a spotreby tejto zlúčeniny sú spôsobené jeho viacerými aplikáciami v odvetviach, ktoré sú rozmanité ako poľnohospodárstvo, petrochemický priemysel, v organickej a anorganickej syntéze a pri liečbe odpadovej vody, aby sme vymenovali iba niektoré niektoré.
Štruktúra kyseliny sírovej
Kyselina sírová je tvorená centrálnym atómom síry s Valencia VI, ktorý je obklopený 4 atómami kyslíka, z ktorých dva sú spojené s atómami vodíka. Jeho štruktúra Lewis je uvedená nižšie:
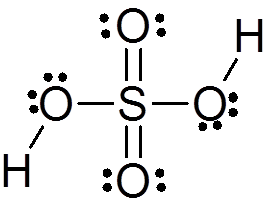
Ako vidíte, síra v tejto zlúčenine je obklopená 12 elektrónmi (6 párov), takže predstavuje jednu z výnimiek z oktetového pravidla.
Byť obklopený 4 atómami, teória odporu elektrónových párov Valencie (Trepev) predpovedá, že táto zlúčenina musí predpokladať približne tetraedrálnu geometriu, ktorá je znázornená na nasledujúcom obrázku:
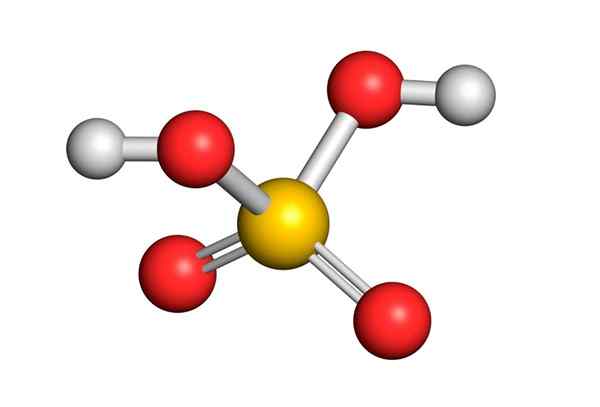
V dôsledku vysokej elektronegativity kyslíka a rôznych rezonančných štruktúr, ktoré môžu mať kyselina sírová.
Vlastnosti kyseliny sírovej
V dôsledku jej štruktúry má kyselina sírová nasledujúce fyzikálne a chemické vlastnosti:
Môže vám slúžiť: epoxid: nomenklatúra, získanie, aplikácie, príkladyFyzikálne vlastnosti
- Čistá kyselina sírová je bezfarebná a toaletná kvapalina, ktorá má hustotu 1 8302 g/ml.
- Jeho bod topenia je 10,31 ° C a varenie je 337 ° C, hoci pri tejto teplote má tendenciu rozkladať sa pri výrobe vody a sírneho anhydridu (tiež nazývaného trioxid siričitý).
- Je úplne miešateľný s vodou, takže môžete pripraviť roztoky s akoukoľvek koncentráciou. Roztoky s viac ako 98,3% v hmotnosti tejto kyseliny sú však nestabilné a kyselina sa rozkladá, až kým jej koncentrácia klesne na 98,3%. Tento roztok je stabilný a je známy ako koncentrovaná kyselina sírová.
- Vo svojom čistom alebo koncentrovanom stave je viskóznejšia tekutina ako voda.
Chemické vlastnosti
- Čistá kyselina sírová je silne oxidačná a korozívna látka. Má schopnosť oxidovať, dehydratovať a sulfonar na širokú škálu organických zlúčenín a karbonizovať ostatných.
- Je to silná diprotická kyselina, ktorá úplne stráca svoj prvý protón rozpustením vody, čím sa stáva jej konjugovanou základňou, bisulfátovým iónom (HSO4-). Tento ión je tiež kyselinou, aj keď slabší ako pôvodná kyselina.
- Roztoky kyseliny kyseliny sírovej sú silne kyslé a sú schopné rozpustiť mnoho kovov, vytvárajúce plynný vodík. Sú tiež schopní úplne neutralizovať silné základne.
- Násilne reaguje s mnohými alkoholmi a vodou a uvoľňuje veľké množstvo tepla v procese.
Ako sa získa kyselina sírová?
Tri najznámejšie procesy výroby kyseliny sírovej sú: proces kontaktu, proces kyseliny sumínovej a procesu olovených kamier.
1. Syntéza kyseliny sírovej pomocou kontaktného procesu
Toto je dnes najpoužívanejšia metóda na výrobu kyseliny sírovej. Proces pozostáva z 5 krokov, v ktorých sa elementárna síra stáva oxidom siričitého (takže2), potom oxid sírou (SO3), kyselina disulfurová (H2Siež2Ani7) a nakoniec v kyseline sírovej. Zahrnuté reakcie sú:
Môže vám slúžiť: Čo je to bezpečnostný rhombus a na čo je to pre?
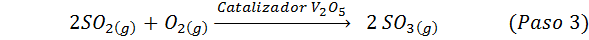


Druhý krok procesu jednoducho pozostáva z čistenia oxidu siričitého pred prevedením na síru alebo trioxid anhydridu sírou. Reakcia tretieho kroku nastane, keď plynný oxid siričitý príde do kontaktu s katalyzátorom solídneho vanádového pentaoxidu (v2Ani5), A preto sa táto metóda nazýva kontaktný proces.
2. Syntéza kyseliny sírovej pomocou mokrého procesu
Tento proces bol navrhnutý tak, aby očistil emisné plyny širokej škály chemických odvetví a rastlín. Vedľajším produktom tohto čistenia je komerčná kyselina sírová, okrem teplej vodnej pary, ktorú je možné znovu použiť v pôvodnom priemyselnom procese.
V prípade mokrého procesu sú reakcie väčšinou. Dôležité reakcie, ktoré sa vyskytujú v každej fáze, sú:
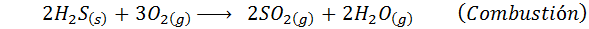
3. Syntéza kyseliny sírovej pomocou procesu olovených kamier
Toto je starodávna metóda na výrobu kyseliny sírovej, ktorá sa dnes používa veľmi málo. Proces bolo spaľovať elementárnu síru v prítomnosti vzduchového kyslíka v drevených komorách potiahnutých olovom, a teda aj jej názov.
Po tomto spaľovaní potom oxid siričitý reaguje s oxidmi dusíka produkovaný rozkladom dusičnanu sodného alebo iným spôsobom. Nakoniec sa po sérii ďalších reakcií získala kyselina sírová.
Môže vám slúžiť: Flaka na pozadíBežné aplikácie
- Hlavná aplikácia kyseliny sírovej je ako zdroj síry vo forme sulfátov pri výrobe hnojív. V skutočnosti je na tento účel určené asi 60% kyseliny sírovej vyrobenej na svete.
- V chemickom priemysle sa používa na syntézu detergentov, pigmentov, katalyzátorov pre petrochemický priemysel a pri spracovaní minerálov na získanie rôznych kovov.
- Nakoniec je kyselina sírová elektrolyt používaný v olovených batériách používaných vo väčšine automobilov.
Riziká spojené s kyselinou sírovou
Kvôli svojim chemickým vlastnostiam môže byť kyselina sírová veľmi nebezpečná pre ľudské bytosti a zvieratá, ako aj pre životné prostredie všeobecne. Toto sú niektoré z rizík spojených s touto chemikáliou:
- Jeho korozívne a dehydratačné charakteristiky spôsobujú, že čistá kyselina spôsobuje veľké poškodenie, ak príde do kontaktu s pokožkou.
- Na druhej strane reakcia vodných roztokov kyseliny sírovej s kovmi vytvára plynný vodík, čo je palivová a výbušná látka.
- Samotná kyselina sírová netrpí spaľovacou reakciou, ale ako silným oxidantom stimuluje spaľovanie iných látok a pôsobí ako druh katalyzátora, takže predstavuje značné riziko požiaru.
- Okrem toho, keď je vystavený ohňu, môže sa rozdeliť na toxické plyny a vytvárať výpary kyseliny sírovej, ktoré môžu ľahko zničiť dýchacie cesty.
Z týchto dôvodov a ďalších je kyselina sírová látka, s ktorou by sa malo zaobchádzať opatrne.