Avogadro zákon
- 1481
- 335
- Denis Škriniar
Čo je to zákon Avogadra?
Ten Avogadro zákon, Tiež sa nazýva Avogadro princíp, je to zákon, ktorý sa vzťahuje na ideálne plyny a bol vyhlásený za vedec devätnásteho storočia s názvom Amadeo Avogadro. Tento zákon uvádza, že dva rovnaké objemy rôznych plynov, ktoré sú v rovnakých podmienkach teploty a tlaku, budú obsahovať rovnaký počet plynných častíc.
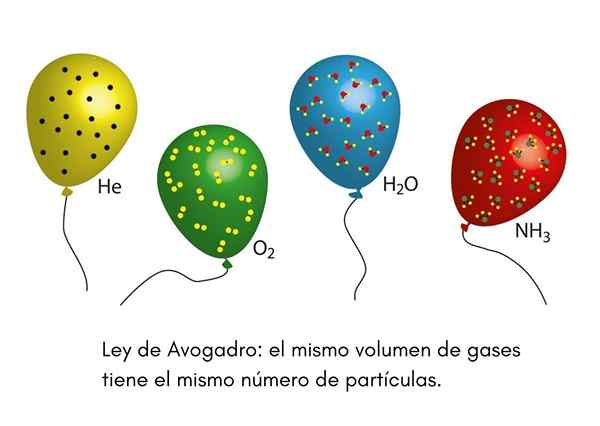
To znamená, že ak máme dva balóny, jeden plný s héliom a druhý s kyslíkom, a oba balóny majú rovnaký objem, rovnaký tlak a rovnakú teplotu, potom bude rovnaký počet atómov plynného hélia v prvom glóbus, že kyslíkové molekuly v druhom.
Avogadro Law Formula
Ďalším spôsobom, ako uviesť zákon Avogadra, je povedať, že ak sa udržiava konštantný tlak a teplota, objem plynu bude úmerný počtu krtkov. Toto je znázornené matematickým spôsobom ako:
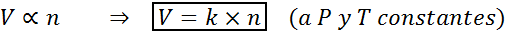
Tento vzorec môže byť usporiadaný do v/n = k, to znamená, že vzťah medzi objemom a počtom krtkov zostáva konštantný vždy, keď sú p a t konštantné.
Takže, ak zavedie alebo odstránime určité množstvo plynu z konštantného konštantného konštantu P a T, objem sa zmení a počiatočný a konečný stav bude súvisieť pomocou nasledujúcej rovnice:

Podmienky, za ktorých je splnený Avogadroov zákon
Tento zákon sa uplatňuje presne na ideálne plyny. Jedná sa o plyny tvorené špecifickými časticami (ktoré nezaberajú objem vo vesmíre), ktoré navzájom nijakým spôsobom neinteragujú.
Môže vám slúžiť: bionafta: história, vlastnosti, typy, výhody, nevýhodyAko už názov napovedá, tento typ plynu neexistuje v skutočnosti, ale v našej fantázii. Sú zjednodušené „nápad“ o tom, o čom veríme, že je plyn. Existujú však určité podmienky, za ktorých sa skutočný plyn, ako napríklad vzduch, správa ideálne: pri veľmi nízkych tlakoch a pri veľmi vysokých teplotách.
Nízke tlaky spôsobujú, že objem obsadený časticami plynu je zanedbateľný v porovnaní s veľkosťou nádoby, zatiaľ čo vysoké teploty spôsobujú, že častice sa pohybujú tak rýchlo, že nemajú čas na interakciu, keď sa navzájom krížia.
Za týchto podmienok väčšina plynov spĺňa Avogadroov zákon s dobrou presnosťou.
Dôležitosť Avogadra zákona
Jedným z najdôležitejších prínosov Avogadra zákona bolo, že umožnil preukázať existenciu základných plynov vytvorených viac ako jedným atómom ako O2 alebo h2. To prispelo k pokroku v atómovej teórii.
Okrem toho, Avogadroov zákon dopĺňa zákony Boyle, Charlesa a Gay-Lussac a ich kombináciu s týmito tromi zákonmi umožňuje Avogadro zákon umožňuje zákon ideálnych plynov, jeden z najdôležitejších zákonov v chémii.
Na druhej strane, Avogadroov zákon tiež umožňuje nadviazať vzťahy medzi molekulárnymi hmotnosťami rôznych plynov, pretože to znamená, že hmotnosť rovnakých objemov rôznych plynov meraných pri rovnakej teplote a tlaku je úmerná hmotnosti každej častice každého plynu.
Môže vám slúžiť: dusičnan sodný (Nano3): štruktúra, vlastnosti, použitia, rizikáTakže pri vzorkách jednej ľútosti dvoch plynov, ktoré zaberajú objemy rovnajúce sa rovnakej teplote a tlaku, je možné získať vzťah medzi molárnymi hmotami.
Príklady Avogadra zákona v každodennom živote
Balóny na párty
Už sme niekedy videli klauna na detskej párty, ktorá nafúkla héliové balóny, aby ich distribuovali medzi deti. Tieto balóny majú približne rovnakú teplotu. Ak sú dva balóniky strany vyplnené rovnakým tlakom a obidve majú rovnakú veľkosť, Avogadroov zákon zaisťuje, že oba balóny budú mať rovnaký počet héliových krtkov.
Na druhej strane, ak je jeden z balónov väčší ako druhý, bude mať väčší objem a podľa Avogadraho zákona bude mať vo vnútri väčšie množstvo héliových častíc.
Pneumatiky auta
Bez ohľadu na to, ktorý plyn je naplnený, pneumatiky na opačných stranách vozidla sú vždy naplnené rovnakým konečným tlakom okolo 32 psi.
Okrem toho vždy zabezpečujeme, aby obidve gumy boli rovnaké, takže budú mať rovnaký objem. Podľa princípu Avogadra teda môžeme povedať, že obe pneumatiky budú obsahovať rovnaký počet plynných častíc.
Injekčná striekačka plná vzduchu
Predpokladajme, že máme otvorenú striekačku a plnú 50 cm3 vzduch. Ako je otvorené, vnútro injekčnej striekačky a exteriér (okolie) sú pri rovnakej teplote a tlaku.
Teraz predpokladajme, že stlačíme piest injekčného striekač3. Keď je injekčná striekačka odkrytá, vzduch unikne špičkou, keď sa piest pohybuje, takže počet častíc vzduchu vo vnútri injekčnej striekačky sa znižuje spolu s objemom.
Môže vám slúžiť: volatilizáciaPretože sa tlak ani teplota menia, zákon Avogadro sa dá použiť na spojenie konečného objemu s množstvom vzduchových častíc, ktoré zostávajú vo vnútri striekačky. Tento vzťah je:

Usporiadanie tejto rovnice, dostaneme to:
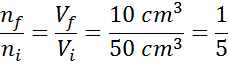
Tento výsledok znamená, že ak znížime objem vo vnútri injekčnej striekačky na piaty, udržiavame P a T konštantu, potom počet mólov alebo častíc prítomných vo vnútri na konci procesu bude tiež piatou časťou toho, čo pôvodne malo.


