Isóbaros
- 661
- 24
- Ing. Ervín Petruška
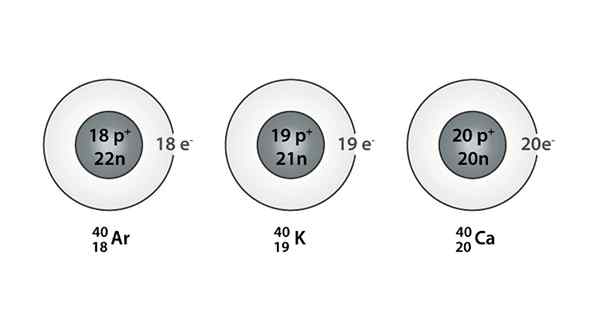
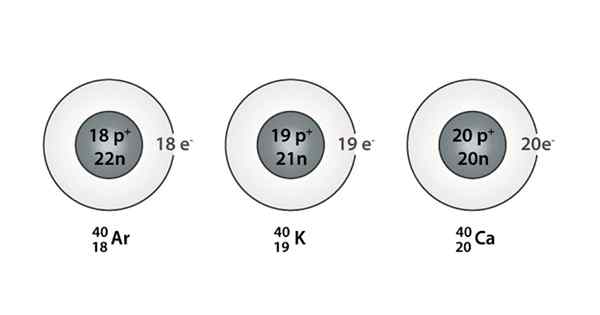 Príklad Isóbaro; Argón, draslík a vápnik, ktoré majú atómy rovnakej hmoty (40)
Príklad Isóbaro; Argón, draslík a vápnik, ktoré majú atómy rovnakej hmoty (40) Čo sú Isoparos?
Ten Isóbaros Sú to tie atómové druhy, ktoré majú rovnakú hmotu, ale ktoré pochádzajú z rôznych chemických prvkov. V dôsledku toho možno povedať, že sú tvorené rôznymi počtami protónov a neutrónov.
Protóny aj neutróny sú v jadre ich atómov, ale čisté množstvo neutrónov a protónov prítomných v každom jadre zostáva rovnaké. Inými slovami, druh Isóbara pochádza, keď pár atómových jadier vykazuje rovnaký čistý počet neutrónov a protónov pre každý druh.
Počet neutrónov a protónov, ktoré predstavujú, že čistá suma je odlišná. Jedným zo spôsobov, ako si všimnúť, je pozorovať hmotnostné číslo (ktoré je umiestnené na ľavej hornej strane symbolu chemického prvku, ktorý je reprezentovaný), pretože v izolách je toto číslo rovnaké rovnaké.
Etymológia termínu Isóbaro pochádza z gréckych slov ISOS (čo znamená „rovnaké“) a Baro (čo znamená „hmotnosť“), ktorá sa týka rovnosti váh medzi oboma jadrovými druhmi.
Charakteristiky Izoparos
- Izoparos udržiava určité podobnosti s inými druhmi, ktorých jadrá prítomné náhody, ako napríklad izotonous, ktoré majú rovnaké množstvo neutrónov, ale s rôznym číslom hmoty a atómového čísla, ako sú rovesníci 13C a 14Nie 36S 37Cl.
- Pojem „jadro“ je nominálna hodnota, ktorá bola vytvorená na každej zo súborov nuklea (štruktúry tvorené neutrónmi a protónmi). Aby sa jadrá pravdepodobne rozlíšili svojím počtom neutrónov alebo protónov alebo dokonca množstvom energie, ktorú má štruktúra jej konglomerácie.
Môže vám slúžiť: skvapalnenie: koncept, plyny, pôdy a seizmické, kľúčové- Podobne existuje detské jadro po β a tento proces je zase izopar otca jadra, pretože počet nukleónov prítomných v jadre zostáva nezmenený, na rozdiel od toho, čo sa deje pomocou dezintegrácie a.
- Je dôležité si uvedomiť, že rôzne Isóbaros majú rôzne atómové číslo, čo potvrdzuje, že ide o rôzne chemické prvky.
Zastúpenie
Na označenie rôznych jadier sa použije špecifický zápis, ktorý môže byť reprezentovaný dvoma spôsobmi: jeden spočíva v umiestnení názvu chemického prvku, po ktorom nasleduje ich hromadné číslo, ktoré je spojené skriptom. Napríklad: dusík-14, ktorého jadro pozostáva zo siedmich neutrónov a siedmich protónov.
Ďalším spôsobom, ako reprezentovať tieto druhy, je umiestniť symbol chemického prvku, ktorému predchádza numerická povera, ktorá naznačuje hmotnostné číslo, ktoré má príslušný atóm, ako aj numerický index, ktorý označuje jeho atómové číslo, nasledujúceho spôsobu :
ZDoX
V tejto expresii x predstavuje chemický prvok príslušného atómu, A je číslo hmotnosti (výsledok pridávania medzi množstvom neutrónov a protónov) a Z predstavuje atómové číslo (rovná množstvu protónov v jadre atóm).
Ak sú tieto jadrá zastúpené, atómové číslo atómu (z) sa zvyčajne vynecháva, pretože neudeľuje relevantné ďalšie údaje, takže je často reprezentované ako DoX.
Jedným zo spôsobov, ako ukázať tento zápis, je vziať predchádzajúci príklad (dusík-14), ktorý sa tiež označuje ako 14N. Toto je notácia použitá pre izoboos.
Môže vám slúžiť: rozsiahle vlastnosti hmotyPríklady Isóbaros
Použitie expresie „isóbaros“ pre druhy známe ako jadrá, ktoré majú rovnaký počet nukleónov (rovnaké množstvo hmotnosti), navrhol chemik britského pôvodu Alfred Walter Stewart na konci 1910.
V tomto poradí nápadov možno v prípade druhu pozorovať príklad izoboos 14C a 14N: Číslo hmotnosti sa rovná 14, to znamená, že počet protónov a neutrónov u oboch druhov je iný.
Tento atóm uhlíka má v skutočnosti atómové číslo rovné 6, takže vo svojej štruktúre je 6 protónov a na druhej strane má vo svojom jadre 8 neutrónov. Potom je vaše hmotnostné číslo 14 (6+8 = 14).
Pokiaľ ide o svoju časť, atóm dusíka má atómové číslo rovné 7, takže sa skladá zo 7 protónov, ale má vo svojom jadre 7 neutrónov 7 neutrónov. Vaše hmotnostné číslo je tiež 14 (7+7 = 14).
Môžete tiež nájsť sériu, v ktorej majú všetky atómy hmotnostné číslo rovné 40; Toto je prípad Isóbaros: 40Ac, 40Klimatizovať, 40Ar, 40Cl, a 40Siež.
Rozdiely medzi izoto a izotopmi
Nucleidy opisujú rôzne druhy atómových jadier, ktoré existujú, podľa množstva protónov a neutrónov, ktoré majú.
Podobne medzi týmito typmi nukleidov sú izotropy a izotopy, ktoré budú diferencované nižšie.
V prípade Isóbarosu, ako už bolo uvedené, majú rovnaký počet nukleónov -to znamená rovnaké hmotnostné číslo -kde počet protónov, pomocou ktorých je jeden druh vyšší ako druhý, súhlasí s počtom neutrónov, ktoré sú v deficit, takže celková suma je rovnaká. Vaše atómové číslo je však iné.
Môže vám slúžiť: kryštaloidné roztoky: zloženie, typy a príkladyV tomto zmysle izopické druhy pochádzajú z rôznych chemických prvkov, takže sa nachádzajú v rôznych priestoroch periodickej tabuľky a majú rôzne vlastnosti a špecifické vlastnosti.
Na druhej strane, v prípade izotopov sa stane opak, pretože majú rovnaké atómové číslo, ale odlišnú hmotnosť; To znamená, že majú rovnaký počet protónov, ale vo svojich atómových jadrách odlišný počet neutrónov.
Izotopy sú navyše atómové druhy patriace k rovnakým prvkom, takže sa nachádzajú v rovnakom priestore v periodickej tabuľke a majú podobné vlastnosti a vlastnosti.

