Histidínové charakteristiky, štruktúra, funkcie, jedlo
- 2339
- 223
- Adrián Fajnor
Ten Histidín (Jeho, h) je to aminokyselina, ktorá sa používa na syntézu proteínov. Je to hydrofilná molekula, takže je všeobecne orientovaná na vonkajšiu stranu proteínových štruktúr, keď sú v kvapalnom médiu.
Považuje sa za esenciálnu aminokyselinu pre pestovanie detí, pretože ju nevyrábajú. U dospelých je malá produkcia histidínu, ale nie je dostatočná na dodanie denných požiadaviek, takže sa považuje za poloestinentnú aminokyselinu.
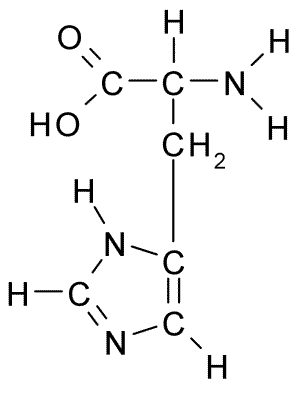
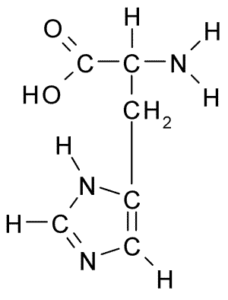 Chemická štruktúra histidínovej aminokyseliny (zdroj: borb, cez Wikimedia Commons)
Chemická štruktúra histidínovej aminokyseliny (zdroj: borb, cez Wikimedia Commons) U zvierat a človeka je histidín nevyhnutnou alebo aspoň poloosenitívnou aminokyselinou, rastliny, huby a mikroorganizmy účinne produkujú histidín, ktorý potrebujú, a sú súčasťou potravinových zdrojov histidínu, okrem proteínových zvierat.
Histidín plní veľmi dôležité fyziologické funkcie v ľudskej bytosti, ako napríklad: tie, ktoré sú súčasťou aktívnych centier mnohých enzýmov, zúčastňujú sa na raste, v imunitnom systéme a pri vytváraní myelínu v nervových vláknach, okrem iného.
Biosyntéza histidínu je komplexný proces, ktorý sa uskutočňuje hlavne v pečeni a vyžaduje 9 až 11 enzymatických krokov. Jeho degradácia sa vyskytuje v pečeni a koži a prechádza tvorbou glutamátu a potom sleduje rôzne cesty.
Mnoho potravín je bohatých na histidín, ako sú živočíšne bielkoviny, ako sú mäso a mliečne výrobky, ako aj rastlinné bielkoviny. Poskytujú veľkú časť denných požiadaviek histidínu, ktoré naše telo musí správne pracovať.
Deficit alebo nadmerný histidín spôsobený zdedením problémov s metabolickým alebo transportom alebo zlyhaním stravovania pri príjme súvisia s niektorými dôležitými problémami, ktoré ovplyvňujú zdravie u detí aj dospelých. Dostatočná spotreba histidínu vám umožňuje udržiavať zdravý a zdravý život vo väčšine prípadov.
[TOC]
Charakteristika
Zdôrazňujúcou charakteristikou histidínu je to, že sa môže premeniť na histamín, látku, ktorá sa aktívne podieľa na mnohých alergických a zápalových reakciách.
U rýb vystavených životnému prostrediu bez dostatočného chladenia môžu baktérie premeniť histidín na histamín, a preto pri požití spôsobujú otravu potravinami.
Ďalšou charakteristikou tejto aminokyseliny je to, že je jednou z mála, medzi existujúcimi 22, v rozsahu fyziologického pH (okolo 7.4) Je ionizovaný, a preto sa môže aktívne zúčastňovať na katalytickom mieste mnohých enzýmov.
V molekule hemoglobínu je proximálny histidín jedným z ligandov skupiny Hemo Group. Inými slovami, táto aminokyselina sa podieľa na funkcii transportu kyslíka hemoglobínu a je nevyhnutná pre syntézu tohto proteínu, ako aj pre myoglobín, ktorý je známy tiež ako „svalový hemoglobín“.
Štruktúra
Histidín je aminokyselina Hydrofilný polárny základný, klasifikované v rámci esenciálnych aminokyselín, pretože ho nemôžu syntetizovať zvieratami. Ako už bolo spomenuté, je syntetizovaný baktériami, hubami a rastlinami.
U rastúcich detí je histidín absolútne nevyhnutný; Dospelý ho môže syntetizovať, ale nie je jasné, či to pokrýva každodenné potreby histidínu, takže sa musí požívať diétou.
Rovnako ako všetky aminokyseliny, aj histidín má uhlík, ku ktorému je spojená aminoskupina, karboxylová skupina, atóm vodíka a bočný reťazec.
Môže vám slúžiť: Coxiella BurnetiiBočný reťazec tejto aminokyseliny je tvorený imidazolovým kruhom, ktorý sa na fyziologické pH protóny a získava pozitívne zaťaženie a nazýva sa “Imidazolio “ skrátene ako IMH+.
Spolu s lyzínom a arginínom tvorí histidín skupinu základných aminokyselín. Z týchto troch je histidín najmenej základný a jeho imididoólica môže byť nechránený na pH takmer 6.
Pretože fyziologický pH histidín môže vymieňať protóny, zvyčajne sa podieľa na enzymatickej katalýze, ktorá zahŕňa prenos protónov. Okrem toho, pretože je to polárna aminokyselina, zvyčajne sa nachádza na vonkajšom povrchu proteínov, kde môže hydratovať vo vodnom médiu.
Funkcia
Ako súčasť lokality aktívneho enzýmu
Histidín je potrebný na syntézu mnohých proteínov, najmä enzýmov, ktorých aktívne centrá majú túto aminokyselinu. Je súčasťou aktívneho centra cicavcov aldlasáz, kde funguje ako darca protónov.
Nachádza sa v aktívnom centre karboxipeptidázy A, pankreatického enzýmu, ktorý má aktívne miesto tvorené Zn a histidínom. V glykolitickom enzýme mutasa fosfoglycerát sú v jeho aktívnom centre dva histidínové odpady, ktoré pôsobia ako akceptory alebo darcovia fosforyl skupín.
Nachádza sa tiež v aktívnom mieste enzýmov, ako je glyceraldehyd 3-fosfát dehydrogenáza, laktát dehydrogenáza, papain, chimotripsín, RNASA A a amoniak liaso histidín (histidáza). Okrem toho je inhibítorom enzýmovej glutamínovej syntetázy.
Iné funkcie
Táto aminokyselina má pre organizmus veľmi dôležitý.
Histidín je produkovaný neurónmi centrálneho nervového systému s neuromodulačnými funkciami.
Je potrebné na tvorbu myelínových strukov nervových vlákien, takže spĺňa dôležitú úlohu pri prenose elektrických impulzov v nich.
Spolu s rastovým hormónom a inými aminokyselinami prispieva histidín k mechanizmom opravy tkanív, hlavne v kardiovaskulárnom systéme.
Niektoré ďalšie funkcie zahŕňajú:
- Prispieva s detoxikáciou niektorých ťažkých kovov, pretože pôsobí ako chelát.
- Chráni pred poškodením spôsobeným žiarením.
- Zúčastnite sa na tvorbe červených a bielych krviniek.
- Je to potrebné na tvorbu hemoglobínu.
- Pomáha bojovať proti niektorým negatívnym účinkom reumatoidnej artritídy, ako je zápal a nedostatok mobility.
- Je to dôležitá aminokyselina pre kapilárnu regeneráciu, rast a sexuálne funkcie.
Karnosín, anserín a homokozín, sú dipéptidy tvorené z histidínu. Prvé dva sa nachádzajú vo svaloch a majú dôležité funkcie, ako sú tampóny a ako aktivátori myozínu atasa.
Homokozín sa vyrába v mozgu v množstvách 100 -krát vyšší ako mäsitý sval kostrovými svalmi.
Biosyntéza
Histidín získava svoj sýtený kostra z 5-fosfátového ribózy. V baktériách A. Coli, Táto aminokyselina sa vyskytuje z uvedenej zlúčeniny pomocou 11 enzymatických krokov:
- Prvý krok syntézy spočíva v prenose fosforribozylu z ATP do uhlíka 1 5-fosfátového ribózy, ktorý vytvára 5-fosforribozyl-1-pyrofosfát (PRPP) (PRPP). Fosforribosyl-pyrofosfát syntetázy (PRPP syntetázy) enzým katalyzuje túto reakciu.
- Potom sa vyskytuje prenos skupiny 1 pyrofosfátu na N-1 ATP a dochádza k n1- (5'-fosforribozyl) -ATP-ATP. Enzým, ktorý katalyzuje túto reakciu, je ATP fosforuseltransferáza.
- Pôsobením fosforribosyl-top-pyrofosfátu hydroxylázy a, β-pyofosfátová väzba ATP je hydroxilaza a N1- sa vytvára (5'-fosforribozyl) -AMP-AMAMP.
- Fosforribozyl-map enzým hydroxyláza otvára purínový kruh medzi N-1 a C-6 a ribonukleotidom je N1- (5'-fosforribosilový formimino) -5-aminoimidazol-4-lribonukleotid.
- Potom sa otvorí prsteň ribofuranosa, ktorý pochádza z PRPP a je izomerizovaný na ketosu, tvoriaci N1- (5'-fosforribozyl formimín) -5-aminoimidazol-4-karboxamid-1-lribonukleotid účinkom enzýmu izomerázy izomerázy.
- Enzým aminotransferáza prenáša uprostred skupiny glutamínu, ktorý sa stáva glutamátom a prelomí formínové spojenie, takže sa vytvára 5-aminoimidazol-karboxamid-1-lribonukleotid a imidazol-glycerolfosfát.
- Molekula vody imidazol-glycerol fosfátu je eliminovaná pomocou imidazol-glycerol fosfátu dehydratázy a tvorí imidazol-acetol fosfát.
- Imidazol-acetol fosfát sa prenáša aminoskupina prostredníctvom histidinolovej transaminázy fosfátu a vytvára sa fosfát histidinol.
- Fosforečná skupina esterov histidinol fosfátu za vzniku histidinolu sa hydrolyzuje. Histidinol fosfát fospatáza katalyzuje túto reakciu.
- Neskôr je histidinol oxidovaný histidinolovou dehydrogenázou a je histidinálny.
- Rovnaký histidinol dehydrogenáza oxiduje na histidinal a robí z nej histidín.
Prvý enzým biosyntetickej cesty histidínu je inhibovaný produktom trasy, to znamená, že histidín sa podieľa na alestrickej inhibícii ATP fosforribosyltransferázy, ktorá predstavuje hlavný mechanizmus regulácie cesty.
Degradácia
Histidín, prolín, glutamát, arginín a glutamín sú aminokyseliny, ktoré, keď nakoniec vytvoria a-zotoglurát. Štyria z nich sa najprv stanú glutamátom, čo v dôsledku transaminácie vedie k a-ketoglutóriu.
Histidín prostredníctvom histidinázy stráca skupinu a-amino, aby sa stala urocanato. Potom urocanáza hydratuje polohy 1 a 4 urocanato, čím tvorí 4-Midazolon-5-propionát. Následne sa vyskytuje Imino skupina 4-Midazolon-5-Propionato, ktorá tvorí N-formiminoglutamato.
Posledná reakcia znamená prenos formylu z n-formiminoglutamátu na tetrahydrofolát, ktorý funguje s formiminálnym prenosom enzýmov glutamátom. Konečnými produktmi tejto reakcie sú glutamát a N5-formimino tetrahydrofolát.
A-ketoglutarát sa tvorí glutamátovou transamináciou. A-ketoglutarát je sprostredkovateľom cyklu Krebs a môže tiež vstúpiť na glukoneogénnu cestu pre tvorbu glukózy.
Glutamato aminoskupina vstupuje do cyklu výroby močoviny, ktorá sa má vylúčiť močom. Všetky tieto reakcie sa vyskytujú v pečeni a ich časť na koži.
Potraviny bohaté na histidín
Denné potreby histidínu sú približne 10 až 11 mg na kg telesnej hmotnosti za deň. U rastúcich detí je histidín esenciálnou aminokyselinou, ktorá sa musí dodávať s diétou.
U iných zvierat je histidín tiež esenciálnou aminokyselinou a tie, ktoré sú chované v stajniach, by mali dostávať histidín, aby sa udržali normálne hladiny hemoglobínu.
Medzi potraviny bohaté na histidín patrí:
- Hovädzie, jahňacie, bravčové, kuracie mäso a morčacie mäso. Nachádza sa tiež v rybách, ako je tuniak (dokonca aj v konzervách), losos, pstruh, pargo a Lubina, ako aj v niektorých morských plodoch.
Môže vám slúžiť: Krvná kultúra: Čo je pre to, nadácia, postup, výsledky- Mlieko a jeho deriváty, najmä v dospelých syr. V domorodcoch, v sére, v jogurte a v kyslej smotane.
- Sójové bôby a orechy, ako sú orechy a semená. V slnečnici, tekvicovej, vodnej melóne, sezame, mandle, pistácii, arašidovom masle a chia.
- Vajcia alebo fazuľa alebo biele fazule.
- Celé zrná ako quinoa, pšenica, integrálna ryža atď.
Výhody vášho príjmu
Existuje množstvo patologických stavov, v ktorých môže byť histidín užitočný ako adjuvant pre liečbu.
Medzi týmito patológiami môžeme pomenovať reumatoidnú artritídu, arteriálnu hypertenziu (od opísania hypotenzívneho účinku histidínu), pri infekciách, chladničke a pohlaví a sluchu, vredoch a anémiách.
V koži degradácia konzumovaného histidínu produkuje kyselinu urocanovú, ktorá je schopná chrániť pokožku, pretože absorbuje ultrafialové lúče.
Nadmerná spotreba zdravých jedincov neprináša veľké zmeny, pretože sa rýchlo degraduje. Použitie doplnkov histidínu v potravinách u pacientov s ťažkými problémami s pečeňou a/alebo obličkami by však malo byť obmedzené.
Poruchy nedostatku
Deficit histidínu súvisí so zmenami v splatnosti imunitnej reakcie.
Boli tiež hlásené problémy s kosťami, hluchota a anémie spojené s deficitom histidínu.
Hartnupova choroba je dedičný stav, ktorý ovplyvňuje transport histidínu a tryptofánu cez sliznicu tenkého čreva a obličiek, čo spôsobuje deficit oboch aminokyselín.
Najdôležitejšími klinickými prejavmi sú výskyt schegóznych a červených lézií v koži po vystavení slnku, rôzne stupne zmeny pohybu a niektoré príznaky psychiatrických chorôb.
Histidinémia je autozomické recesívne ochorenie, ktoré sa vyznačuje deficitom enzýmu histidázy, čo spôsobuje zvýšenie koncentrácií histidínu v krvi a moči.
V dôsledku toho títo pacienti nemôžu degradovať histidín na urociálnu kyselinu v pečeni a koži. Toto ochorenie je sprevádzané miernou mentálnou retardáciou, defektmi reči a sluchovou pamäťou bez hluchoty.
Obmedzenie príjmu histidínu ako liečby nebolo účinné pri vytváraní klinického zlepšenia a predstavuje riziko vzniku porúch rastu u detí postihnutých týmto ochorením.
Odkazy
- Mathews, C., Van Holde, K., & Ahern, K. (2000). Biochémia (3. vydanie.). San Francisco, Kalifornia: Pearson.
- Murray, r., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harperova ilustrovaná biochémia (28. ED.). McGraw-Hill Medical.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger princípy biochémie. Vydanie omega (5. vydanie.). doi.orgán
- Perecarz, P., Farri, L., & Pageorgiou, a. (1983). Účinky ľudského mlieka a vzorcov s nízkym obsahom proteínu na rýchlosť posunu celkového telesného proteínu a vylučovania predčasne narodených detí v moči 3-metylhistidín. Klinická veda, 64, 611-616.
- Song, b. C., Joo, n., Aldini, G., & Yeum, k. (2014). Biologická funkcia histidín-dipeptidov a metabolického syndrómu. Výživa a prax výživy, 8(1), 3-10.
- « Vlastnosti kyslíka, štruktúra, riziká, použitie
- História expertných systémov, charakteristiky, výhody, nevýhody »

