Vlastnosti kyslíka, štruktúra, riziká, použitie

- 5036
- 101
- Tomáš Klapka
On kyslík Je to chemický prvok, ktorý je znázornený symbolom alebo. Je to veľmi reaktívny plyn, ktorý vedie skupinu 16: Kalkogény. Toto meno je skutočnosť, že síra a kyslík sú prítomné takmer vo všetkých mineráloch.
Jeho vysoká elektronegativita vysvetľuje svoju veľkú aviditu elektrónmi, čo vedie k kombinácii s vysokým počtom prvkov; Takto vzniká široká škála oxidov minerálov, ktoré obohacujú zemskú kôru. Zostávajúci kyslík teda tvorí a robí atmosféru priedušnou.
 Kyslík je zvyčajne synonymom vzduchu a vody, ale nachádza sa tiež v skalách a mineráloch. Zdroj: pxhere.
Kyslík je zvyčajne synonymom vzduchu a vody, ale nachádza sa tiež v skalách a mineráloch. Zdroj: pxhere. Kyslík je tretím prvkom hojnosti vo vesmíre, za vodíkom a héliom a je tiež hlavnou hmotnou zložkou Zeme kôry. Má percento objemu 20,8% zemskej atmosféry a predstavuje 89% hmotnosti vody.
Zvyčajne má dve alotropné formy: diatomický kyslík (alebo2), čo je najčastejším spôsobom v prírode a ozón (alebo3), nájdené v stratosfére. Existujú však dvaja ďalší (alebo4 I8), ktoré existujú vo svojich tekutých alebo tuhých fázach a pod obrovskými tlakmi.
Kyslík sa neustále vyrába prostredníctvom procesu fotosyntézy, vykonávaný fytoplanktónom a suchozemskými rastlinami. Po vyprodukovaní je uvoľnená tak, aby ich mohli používať živé bytosti, zatiaľ čo jeho malá časť sa rozpúšťa v moriach a podporuje vodný život.
Je preto nevyhnutným prvkom pre živé bytosti; Nielen preto, že je prítomná vo väčšine zlúčenín a molekúl, ktoré ich tvoria, ale tiež zasahujú do všetkých svojich metabolických procesov.
Aj keď kontroverzne jej izolácia pripisuje Carl Scheele a Joseph Priestley v roku 1774, existujú náznaky, že kyslík bol v skutočnosti prvýkrát izolovaný v roku 1608, Michael Sendivogius.
Tento plyn sa používa v lekárskej praxi na zlepšenie životných stavov pacientov s dýchacími problémami. Podobne sa kyslík používa na umožnenie ľuďom plniť svoje funkcie v prostrediach, v ktorých je znížený alebo žiadny prístup k atmosférickému kyslíku.
Komerčne vyrobený kyslík sa používa hlavne v metalurgickom priemysle na konverziu železa na oceľ.
[TOC]
História
Nitroariálny duch
V roku 1500 Leonardo da Vinci na základe experimentov Phila de Byzantium, ktoré sa konali v druhom storočí. C., Dospel k záveru, že časť vzduchu bola spotrebovaná počas spaľovania a dýchania.
V roku 1608 Cornelius Drebble ukázal, že vykurovacia miestnosť (dusičnan strieborná, Kno3) Došlo k plynu. Tento plyn, ako by to bolo známe neskôr, bol kyslík; Ale Drebble to nedokázal identifikovať ako nový prvok.
Potom, v roku 1668, John Majow poukázal na to, že časť vzduchu, ktorý nazval „Spiritus nitroaerus“, je zodpovedná za požiar a že sa konzumovala aj počas dýchania a spaľovania látok. Majow poznamenal, že látky nezariadili v neprítomnosti nitroariálneho ducha.
Majoow vykonal spaľovanie antimónov a pozoroval zvýšenie hmotnosti antimónu počas jeho spaľovania. Potom Majow dospel k záveru, že antimón kombinovaný s nitroariálnym duchom.
Objavenie
Aj keď nedostal uznanie od vedeckej komunity, v živote alebo po jeho smrti, Michael Sandivogius (1604) bude pravdepodobne skutočným objavovateľom kyslíka.
Sandivogius bol alchymista, filozof a švédsky lekár, ktorý produkoval tepelný rozklad dusičnanu draselného. Jeho experimenty ho priviedli k prepusteniu kyslíka, ktoré nazval „Cibus Vitae“: Food of Life.
V rokoch 1771 až 1772 švédsky chemik Carl W Scheele zahrial niekoľko zlúčenín: dusičnan draselný, oxid mangánu a oxid ortuti. Scheele poznamenal, že z nich bol prepustený plyn, ktorý zvýšil spaľovanie, a na ktorý nazval „Fire Air“.
Joseph Priestly Experimenty
V roku 1774 anglický chemik Joseph Priestly zahrial oxid ortuti pomocou dvanásť -palcovej šošovky, ktorá koncentrovala slnečné svetlo. Oxid ortuti prepustil plyn, ktorý spôsobil, že sviečka spaľuje oveľa rýchlejšie ako obvykle.
Okrem toho kňazne testoval biologický účinok plynu. Za týmto účelom umiestnil do uzavretej nádoby myš, ktorú očakával, že prežije pätnásť minút; Avšak v prítomnosti plynu prežil hodinu, viac, ako odhadoval.
Kňazly zverejnil svoje výsledky v roku 1774; Zatiaľ čo Scheele to urobil v roku 1775. Z tohto dôvodu sa zvyčajne pripisuje objav kyslíka na kňaz.
Kyslík vo vzduchu
Antoine Lavoisier, francúzsky chemik (1777), zistil, že vzduch obsahuje 20% kyslík a že keď látka horí, v skutočnosti sa kombinuje s kyslíkom.
Lavoisier dospel k záveru, že zjavný prírastok hmotnosti, ktorý látky, ktoré sa vyskytli počas spaľovania, bol spôsobený chudnutím, ku ktorému dochádza vo vzduchu; Pretože kyslík kombinovaný s týmito látkami, a preto sa zachovali hmoty reaktantov.
To umožnilo spoločnosti Lavoisier ustanoviť zákon o zachovaní hmoty. Lavoisier navrhol názov kyslíka, ktorý pochádza z tvorby kyseliny „Oxys“ a „gény“. Potom kyslík znamená „bývalú kyselinu“.
Toto meno je nesprávne, pretože nie všetky kyslíky obsahujú kyslík; Napríklad halogenidy vodíka (HF, HCL, HBR a HI).
Dalton (1810) priradený k vode chemický vzorec Ho, a preto atómová hmotnosť kyslíka bola 8. Skupina chemikálií vrátane: Davy (1812) a Berzelius (1814) opravili Daltonov prístup a dospeli k záveru, že správny vzorec vody je H2O a atómová hmotnosť kyslíka je 16.
Môže vám slúžiť: disionizovaná vodaFyzikálne a chemické vlastnosti
Vzhľad
Bezfarebný, toaletný a bez chuti; Zatiaľ čo ozón má zápach akra. Kyslík uprednostňuje spaľovanie, ale sám osebe to nie je palivo.
 Kvapalný kyslík. Zdroj: Zamestnanci Sgt. Nika Glover, u.Siež. Letectvo [verejná doména]
Kvapalný kyslík. Zdroj: Zamestnanci Sgt. Nika Glover, u.Siež. Letectvo [verejná doména] Vo svojej kvapalnej forme (horný obrázok) je bledomodrý a jeho kryštály sú tiež moderné; Ale môžu získať ružové, oranžové a dokonca červenkasté tóny (ako bude vysvetlené v časti jej štruktúry).
Atómová hmotnosť
15 999 u.
Atómové číslo (z)
8.
Bod topenia
-218,79 ° C.
Bod varu
-182 962 ° C.
Hustota
V normálnych podmienkach: 1 429 g/l. Kyslík je hustejší plyn ako vzduch. Okrem toho je to zlý vodič tepla a elektriny. A vo svojom bode varu (kvapalina) je hustota 1 141 g/ml.
Trojitý bod
54 361 K a 0,1463 kPa (14,44 atm).
Kritický bod
154 581 K a 5 043 MPa (49770,54 ATM).
Fúzne teplo
0,444 kJ/mol.
Odparovanie
6,82 kj/mol.
Molárna kalikára
29 378 J/(mol · k).
Tlak vodnej pary
Pri teplote 90 K má tlak pary 986,92 atm.
Oxidačné stavy
-2, -1, +1, +2. Najdôležitejší stav oxidácie je -2 (alebo2-).
Elektronegativita
3.44 v Pauling Scale
Ionizačná energia
Prvé: 1.313,9 kj/mol.
Po druhé: 3.388,3 kJ/mol.
Tretie: 5.300,5 kJ/mol.
Magnetický poriadok
Paramagnetický.
Rozpustnosť
Rozpustnosť kyslíka vo vode klesá so zvyšovaním teploty. Napríklad: 14,6 ml kyslíka/l vody sa rozpustí pri 0 ° C a 7,6 ml kyslíka/l vody pri 20 ° C. Rozpustnosť kyslíka v pitnej vode je väčšia ako v morskej vode.
V podmienkach teploty 25 ° C a pri tlaku 101,3 kPa môže pitná voda obsahovať 6,04 ml kyslíka/l vody; Zatiaľ čo voda z morskej vody iba 4,95 ml kyslíka/l vody.
Reaktivita
Kyslík je vysoko reaktívny plyn, ktorý reaguje priamo s takmer všetkými prvkami pri izbovej teplote a vysokých teplotách; s výnimkou kovov s vyšším redukčným potenciálom ako meď.
Môžete tiež reagovať so zlúčeninami a oxidovať prvky prítomné v nich. To sa stane, keď reaguje napríklad s glukózou, napríklad na výrobu vody a oxidu uhličitého; alebo keď drevo alebo uhľovodíky horí.
Kyslík môže akceptovať elektróny úplným alebo čiastočným prenosom, takže sa považuje za oxidačné činidlo.
Najbežnejšie oxidačné číslo alebo stav oxidácie je -2. S týmto oxidačným číslom sa nachádza vo vode (h2O), oxid siričitý (SO2) a oxid uhličitý (CO2).
Tiež v organických zlúčeninách, ako sú aldehydy, alkoholy, karboxylové kyseliny; bežné kyseliny ako H2SW4, H2Co3, Hned3; a vo svojich odvodených soli: na2SW4, Nat2Co3 dobre nie3. Vo všetkých z nich by sa mohla predpokladať existencia O2- (čo neplatí pre organické zlúčeniny).
Oxidy
Kyslík je prítomný ako alebo2- V kryštalických štruktúrach oxidov kovu.
Na druhej strane v kovových superoxidoch, ako je superoxid draslíka (KO2), kyslík je ako ión alebo2-. Zatiaľ čo v peroxidoch kovu, povedzme peroxid bária (bao2), kyslík je prezentovaný ako ión alebo22- (BA2+Ani22-).
Izotopy
Kyslík má tri stabilné izotopy: 16Alebo s 99,76% hojnosťou; on 17Alebo s 0,04%; a 18Alebo s 0,20%. Všimnite si, že on 16Alebo je to zďaleka najstabilnejší a najhojnejší izotop.
Elektronická štruktúra a konfigurácia
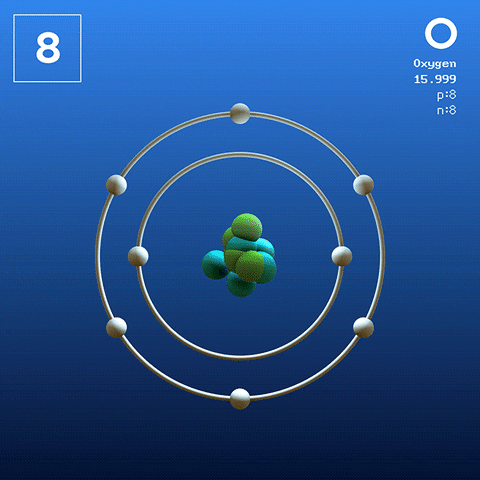
Molekula kyslíka a interakcie
 Molekula kyslíka. Zdroj: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Molekula kyslíka. Zdroj: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Kyslík vo svojom bazálnom stave je atóm, ktorého elektronická konfigurácia je:
[On] 2s2 2 P4
Podľa teórie Link Valencia (TEV) sú dva atómy kyslíka kovalentne spojené tak, aby obidve samostatne dokončili svoj oktet Valencia; Okrem toho, že sú schopní spájať svoje dva osamelé elektróny orbitálov 2p.
Týmto spôsobom sa objaví kyslíková diatomická molekula, alebo2 (Vyšší obrázok), ktorý má dvojitú väzbu (o = o). Jeho energetická stabilita je taká, že kyslík sa nikdy nenachádza ako jednotlivé atómy v plynnej fáze, ale ako molekuly.
Pretože o2 Je homonukleárny, lineárny a symetrický, chýba trvalý dipólový moment; Preto jeho intermolekulárne interakcie závisia od jej molekulárnej hmoty a londýnskych disperzných síl. Tieto sily sú relatívne slabé pre kyslík, čo vysvetľuje, prečo ide o plyn v suchozemských podmienkach.
Keď však teplota klesne alebo zvyšuje tlak, molekuly alebo2 Sú nútení súdržať súdržnosť; do tej miery, že ich interakcie sa stanú významnými a umožňujú tvorbu kvapalného alebo tuhého kyslíka. Aby ste sa im molekulárne porozumeli, je potrebné nestratiť zo zreteľa O2 ako konštrukčná jednotka.
Ozón
Kyslík môže prijať ďalšie značne stabilné molekulárne štruktúry; To znamená, že sa nachádza v povahe (alebo v laboratóriu) v rôznych alotropných formách. Ozón (nižší obrázok), alebo3, Napríklad je to druhý alotrope najznámejšieho kyslíka.
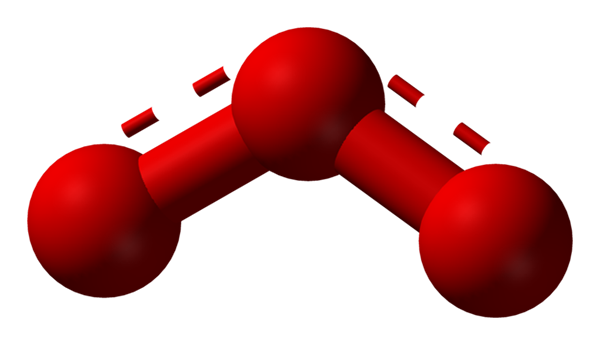 Štruktúra rezonančného hybridu predstavovaného modelom guľôčok a tyčí pre molekulu ozónu. Zdroj: Ben Mills Via Wikipedia.
Štruktúra rezonančného hybridu predstavovaného modelom guľôčok a tyčí pre molekulu ozónu. Zdroj: Ben Mills Via Wikipedia. TEV opäť drží, vysvetľuje a demonštruje, že v OR3 Musia existovať rezonančné štruktúry, ktoré stabilizujú pozitívne formálne zaťaženie stredného kyslíka (čiary posiate červenou farbou); Zatiaľ čo kyslík od konca boomerangu je distribuované záporné zaťaženie, čo spôsobuje celkové zaťaženie ozónu.
Môže vám slúžiť: Pravidlá rozpustnosti: Všeobecné aspekty a pravidláTýmto spôsobom nie sú odkazy jednoduché, ale nie dvojnásobné. Príklady rezonančných hybridov sú veľmi bežné v mnohých molekulách alebo anorganických iónoch.
O2 I3, Výsledkom je, že ich molekulárne štruktúry sú rôzne, to isté platí pre ich fyzikálne a chemické vlastnosti, kvapalné alebo kryštalické fázy (aj keď obe spotrebujú atómy kyslíka). Teoretizujú, že syntéza vo veľkých mierkach cyklického ozónu je pravdepodobná, ktorej štruktúra pripomína štruktúru červenkastého a okysličeného trojuholníka.
Zatiaľ prídu „normálne alotropy“ kyslíka. Existujú však dvaja ďalší, čo treba zvážiť: o4 I8, nájdené alebo navrhnuté v kvapalnom a tuhom kyslíku.
Kvapalný kyslík
Plynný kyslík je bezfarebný, ale keď teplota zostupuje na -183 ° C, kondenzuje v bledomodrej kvapaline (nebeská podobná). Interakcie medzi molekulami alebo2 Teraz aj ich elektróny dokážu absorbovať fotóny v červenej oblasti viditeľného spektra, aby odrážali jeho charakteristickú modrú farbu.
Predpokladá sa však, že v tejto kvapaline sú viac ako jednoduché molekuly alebo2, ale tiež molekula alebo4 (nižší obrázok). Vyzerá to, že ozón „zasekol“ ďalší atóm kyslíka, ktorý sa nejako prihováral novo opísanou formálnou formálnou záťažou.
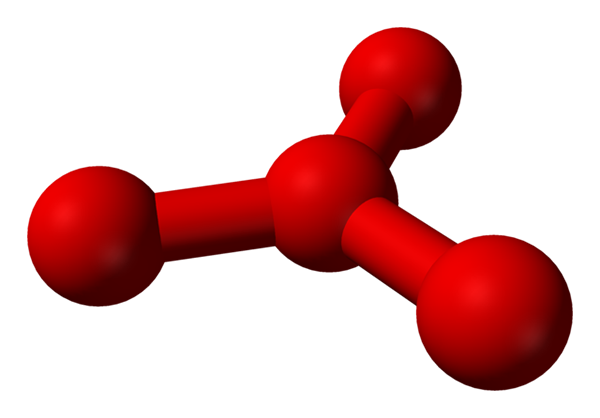 Model navrhol štruktúru s guľami a tyčami pre molekulu tetraoxygénu. Zdroj: Benjah-Bmm27 [verejná doména]
Model navrhol štruktúru s guľami a tyčami pre molekulu tetraoxygénu. Zdroj: Benjah-Bmm27 [verejná doména] Problém je v tom, že podľa počítačových a molekulárnych simulácií, uvedená štruktúra pre O4 Nie je presne stabilný; Predpovedajú však, že existujú ako jednotky (alebo2)2, to znamená, dve molekuly O2 Približujú sa natoľko, že tvoria určitý druh nepravidelného rámca (atómy alebo nie sú navzájom zarovnané).
Pevný kyslík
Akonáhle teplota zostúpi na -218,79 ° C, kyslík kryštalizuje v jednoduchej kubickej štruktúre (y fáza). Keď teplota ešte viac klesá, kubické sklo trpí prechodmi na β fázy (rhomboédiica a pri -229,35 ° C) a a (monoklinické a pri -249,35 ° C).
Všetky tieto kryštalické fázy tuhého kyslíka sa vyskytujú pri okolitom tlaku (1 atm). Keď sa tlak zvyšuje na 9 GPa (~ 9000 atm), objaví sa fáza δ, ktorej kryštály sú oranžové. Ak sa tlak naďalej zvyšuje na 10 GPA, objaví sa červený tuhý kyslík alebo fáza ε (opäť monoklinická).
Fáza ε je špeciálna, pretože tlak je taký obrovský, že molekuly alebo2 Nielenže sú ubytovaní ako jednotky alebo4, ale tiež resp8:
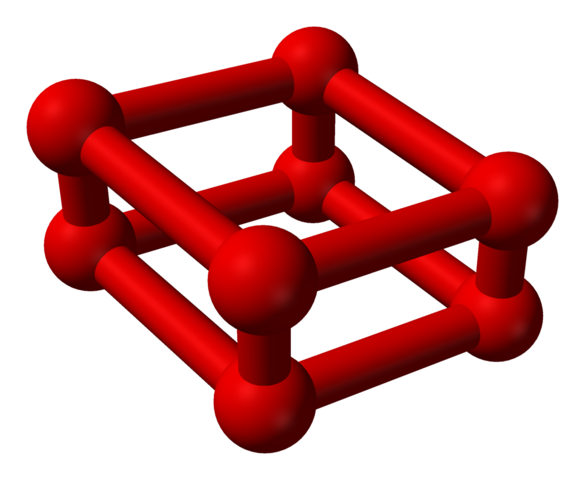 Modelová štruktúra s guľami a tyčami pre molekulu oktaoxygen. Zdroj: Benjah-Bmm27 [verejná doména]
Modelová štruktúra s guľami a tyčami pre molekulu oktaoxygen. Zdroj: Benjah-Bmm27 [verejná doména] Všimnite si, že toto alebo8 Pozostáva z dvoch jednotiek alebo4 kde už vysvetlil nepravidelný rámec. Je tiež platné, aby ste to považovali za štyri alebo2 úzko zarovnané a vo vertikálnych polohách. Jeho stabilita je však pod týmto tlakom, že alebo4 I8 Sú to dva ďalšie alotropy pre kyslík.
A nakoniec máme fázu ζ, kovové (do tlaku väčšieho ako 96 GPA), v ktorej tlak spôsobuje, že elektróny sa rozptyľujú v skle; Rovnako ako v prípade kovov.
Kde je a výroba
Minerály
Kyslík je v hmotnosti tretí prvok vesmíru, za vodíkom a héliom. Predstavuje najhojnejší prvok zemskej kôry, ktorá predstavuje asi 50% jej hmoty. Je kombinovaný hlavne so kremíkom vo forme oxidu kremíka (SIO2).
Kyslík je súčasťou nespočetných minerálov. Podobne sa nachádza ako súčasť mnohých zlúčenín, ako sú uhličitany, fosfáty, sulfáty, dusičnany atď.
Vysielať
Kyslík predstavuje 20,8% objemu atmosférického vzduchu. V troposfére je to hlavne ako diatomická molekula kyslíka. Zatiaľ čo v stratosfére je plynná vrstva medzi 15 a 50 km zemského povrchu, ako ozón.
Ozón sa vyrába elektrickým šokom na molekule O2. Tento veľa kyslíka absorbuje ultrafialové svetlo slnečného žiarenia a blokuje jeho škodlivé pôsobenie na ľudí, ktoré je v extrémnych prípadoch spojené s výskytom melanómov.
Čerstvá a slaná voda
Kyslík je hlavnou súčasťou morskej vody a sladkej vody z jazier, riek a podzemnej vody. Kyslík je súčasťou chemického vzorca vody, ktorý z neho hromadí 89%.
Na druhej strane, hoci rozpustnosť kyslíka vo vode je relatívne nízka, množstvo kyslíka rozpusteného v tomto je nevyhnutné pre vodný život, ktorý zahŕňa početné druhy zvierat a rias.
Živé bytosti
Vytvára sa ľudská bytosť, približne 60% vody a zároveň bohaté na kyslík. Ale navyše je kyslík súčasťou mnohých zlúčenín, ako sú fosfáty, uhličitany, karboxylové kyseliny, ketóny atď., ktoré sú nevyhnutné pre život.
Kyslík je tiež prítomný u polysacharidov, lipidov, proteínov a nukleových kyselín; to znamená, že takzvané biologické makromolekuly.
Je tiež súčasťou škodlivého odpadu činnosti človeka, napríklad: oxid uhličitý a oxid, ako aj oxid siričitý.
Biologická výroba
 Rastliny sú zodpovedné za obohatenie kyslíkového vzduchu výmenou za oxid uhličitý, ktorý vydýchneme. Zdroj: pexels.
Rastliny sú zodpovedné za obohatenie kyslíkového vzduchu výmenou za oxid uhličitý, ktorý vydýchneme. Zdroj: pexels. Kyslík sa vyskytuje počas fotosyntézy, proces, ktorým morský fytoplanktón a suchozemské rastliny používajú ľahkú energiu na reagovanie oxidu uhličitého s vodou, čo spôsobuje glukózu a uvoľňuje kyslík.
Odhaduje sa, že viac ako 55% kyslíka produkovaného fotosyntézou je spôsobené pôsobením morského fytoplanktónu. Preto predstavuje hlavný zdroj výroby kyslíka na Zemi a je zodpovedný za udržiavanie života v ňom.
Priemyselná produkcia
Skvapalnenie vzduchu
Hlavná metóda výroby priemyselného kyslíka je vytvorená v roku 1895, nezávisle Karl Paul Gottfried von Linde a William Hamson. Táto metóda v súčasnosti používa niektoré úpravy.
Môže vám slúžiť: butanone: štruktúra, vlastnosti a použitiaProces začína kompresiou vzduchu na kondenzáciu vodnej pary, a tak ju eliminuje. Potom sa vzduch preosieva, keď sa vykonáva zmesou zeolitu a silikagélu, na elimináciu oxidu uhličitého, ťažkých uhľovodíkov a zvyšku vody.
Následne sa komponenty kvapalného vzduchu oddeľujú frakčnou destiláciou, čím sa dosiahne oddelenie plynov prítomných v rôznych bodoch varu. Touto metódou sa kyslík získa s 99% čistotou.
Elektrolýza vody
Kyslík sa vyrába vysoko purifikovanou elektrolýzou vody a s elektrickou vodivosťou, ktorá nepresahuje 1 uS/cm. Voda je oddelená elektrolýzou vo svojich komponentoch. Vodík ako katión sa presúva do katódy (-); Kým sa kyslík pohybuje smerom k anóde (+).
Elektródy majú špeciálnu štruktúru na zhromažďovanie plynov a následne ich skvapalnenie.
Tepelný rozklad
Tepelný rozklad zlúčenín, ako je ortuťový oxid a hostiteľ (dusičnan draselný), uvoľňuje kyslík, ktorý sa môže zbierať na použitie. Na tento účel sa používajú aj peroxidy.
Biologický dokument
Kyslík sa vyrába pomocou fotosyntézy pomocou Phytoplankton a Land Rastles. Prechádza cez pľúcnu stenu av krvi je zachytená hemoglobínom, ktorý ju transportuje do rôznych orgánov a potom sa používa v bunkovom metabolizme.
V tomto procese sa kyslík používa počas metabolizmu uhľohydrátov, mastných kyselín a aminokyselín, aby sa v konečnom dôsledku vytvoril oxid uhličitý a energia.
Dýchanie sa môže schematizovať takto:
C6H12Ani6 + Ani2 => Co2 + H2Alebo +energia
Glukóza sa metabolizuje v súbore sekvenčných chemických procesov, ktoré zahŕňajú glykolýzu, cyklus Krebs, elektronický transportný reťazec a oxidačnú fosforyláciu. Táto séria udalostí produkuje energiu, ktorá sa hromadí ako ATP (Adenosín Triposfát).
ATP sa používa v rôznych procesoch v bunkách, ktoré zahŕňajú transport iónov a iných látok cez plazmatickú membránu; črevná absorpcia látok; kontrakcia rôznych svalových buniek; Metabolizmus rôznych molekúl atď.
Polymorfonukleárne a makrofágové leukocyty sú fagocytárne bunky, ktoré sú schopné používať kyslík na produkciu superoxidového iónu, peroxidu vodíka a jediného kyslíka, ktoré sa používajú na zničenie mikroorganizmov.
Riziká
Dýchanie kyslíka do vysokých tlakov môže spôsobiť nevoľnosť, závraty, svalové kŕče, strata zraku, záchvaty a strata vedomia. Okrem toho dýchanie čistého kyslíka po dlhú dobu spôsobuje pľúcne podráždenie, prejavené kašľom a skrátením dýchania.
Môže to byť tiež príčinou tvorby pľúcneho edému: veľmi vážny stav, ktorý obmedzuje dýchaciu funkciu.
Atmosféra s vysokou koncentráciou kyslíka môže byť nebezpečná, pretože uľahčuje vývoj požiarov a výbuchov.
Žiadosti
Lekári
Kyslík sa podáva pacientom, ktorí majú respiračné zlyhanie; To je prípad pacientov postihnutých pneumóniou, pľúcnym edémom alebo emfyzémom. Nemohli dýchať environmentálny kyslík, pretože by boli vážne ovplyvnené.
Pacienti so srdcovým zlyhaním v akumulácii kvapaliny v alveoli tiež potrebujú dodanie kyslíka; Rovnako ako pacienti, ktorí utrpeli ťažkú vaskulárnu nehodu (mozgová príhoda).
Pracovné potreby
Hasiči, ktorí bojujú proti požiaru v prostredí s nevhodným vetraním, vyžadujú použitie masiek a kyslíkovej fľaše, ktoré im umožňujú plniť svoje funkcie, bez toho, aby ich životy vystavili väčšie riziká.
Ponorky sú vybavené výrobným zariadením kyslíka, ktoré umožňuje námorníkom zostať v uzavretom prostredí bez prístupu k atmosférickému vzduchu.
Potápači vykonávajú svoju prácu ponorenú do vody, a preto izolovaní z atmosférického vzduchu. Dýchajú kyslíkom čerpané trubicami pripojenými k ich skenovaniu alebo použitím bombových bombových vozidiel pripevnených k telu ponorky.
Astronauti vykonávajú svoje činnosti v prostrediach vybavených generátormi kyslíka, ktoré umožňujú prežitie počas vesmírnych výletov a vo vesmírnej stanici.
Priemyselný
Viac ako 50% priemyselne vyrábaného kyslíka sa spotrebuje pri transformácii železa na oceľ. Liatine sa injektuje kyslíkový prúd, aby sa eliminovala prítomnosť síry a uhlíka; reagovať na výrobu tak plyn2 a co2, respektíve.
Acetylén sa používa v kombinácii s kyslíkom na rezanie kovových dosiek a tiež na výrobu jeho zvárania. Kyslík sa tiež používa pri výrobe skla, čím sa zvyšuje spaľovanie pri pečení, aby sa zlepšila jeho priehľadnosť.
Atómová absorpčná spektrofotometria
Kombinácia acetylénu a kyslíka sa používa na spaľovanie vzoriek rôznych pôvodov v atómovom absorpčnom spektrofotometre.
Počas procedúry je lúč svetla z lampy ovplyvnené plameňom, ktorý je špecifický pre prvok, ktorý sa požaduje na kvantifikáciu. Plameň absorbuje svetlo žiarovky, čo umožňuje kvantifikáciu prvku.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Kyslík. Zdroj: In.Wikipedia.orgán
- Richard Van Noordden. (13. september 2006). Len pekná fáza? Pevná červená kyslík: zbytočné, ale príjemné. Získané z: Prírody.com
- Azonano. (4. decembra 2006). Struptúra E-fázy s pevnou kyslíkou E-fázy stanovená pozdĺž objavov klastra kyslíka O8. Získané z: Azonano.com
- Národné centrum pre biotechnologické informácie. (2019). Molekula kyslíka. Databáza pubchem. CID = 977. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- DR. Doug Stewart. (2019). Fakty kyslíka. Chemickolák. Získané z: Chemicool.com
- Robert C. Zapálený. (9. júla 2019). Kyslík: chemický prvok. Encyclopædia Britannica. Získané z: Britannica.com
- Wiki deti. (2019). Kyslíková rodina: Vlastnosti prvkov VIA. Obnovené z: jednoducho.Veda
- Adameg, Inc. (2019). Kyslík. Získané z: Made -How.com
- Šošovica B.Vložka. (2019). Tabuľka doby: kyslík. Získané z: Lentech.com
- Ministerstvo zdravotníctva v New Jersey a služby seniorov. (2007). Kyslík: SKLADOVÁ SKLADOVÁ LÁTKA. [PDF]. Získané z: NJ.Vláda
- Yamel Mattarollo. (26. augusta 2015). Priemyselné priemyselné aplikácie. Získané z: Altecdust.com
- « Neónová história, vlastnosti, štruktúra, riziká, použitie
- Histidínové charakteristiky, štruktúra, funkcie, jedlo »

