Hydroxid strontium (SR (OH) ₂)

- 1063
- 275
- MUDr. Miloslav Habšuda
 Hydroxid strontium
Hydroxid strontium Čo je to hydroxid strontium?
On Hydroxid strontium (SR (OH) ₂) je anorganická chemická zlúčenina tvorená strontiálnym iónom (SR) a dvoma hydroxidovými iónmi (OH). Táto zlúčenina sa získa kombináciou soli Strol so silnou bázou, ktorá vedie k zlúčenine alkalickej povahy, ktorej chemický vzorec je SR (OH)2.
Vo všeobecnosti sa na prípravu hydroxidu stroncia, hydroxidu sodného (NaOH) alebo hydroxidu draselného (KOH) používa ako silná báza. Na druhej strane, strontium soľ (alebo ión stroncia), ktorá reaguje so silnou základňou3)2 A proces je opísaný nasledujúcou chemickou reakciou:
2KOH + SR (nie3)2 → 2kno3 + SR (OH)2
V roztoku katión Strontium (SR+) Dostane sa v kontakte s aniónom hydroxidu (OH-) tvorenie základnej iónovej strontium soli. Pretože stroncium je alkalický kov, hydroxid strontium sa považuje za žieravú alkali zlúčeninu.
Získanie hydroxidu stroncia
Okrem predtým vysvetleného procesu sa dá povedať, že akonáhle sa reakcia vykoná, SR (OH)2 Zráža sa v roztoku. Potom je to vystavené procesu premytia a sušenia, konečne získanie veľmi jemného bieleho prášku.
Alternatívna metóda na získanie hydroxidu stroncia je z zahrievania uhličitanu stroncia (SRCO3) alebo sulfát stroncia (SRSO4), s parou pri teplote v rozsahu medzi 500 ° C a 600 ° C. K chemickej reakcii dochádza, ako je uvedené nižšie:
SRCO3 + H2O → sr (OH)2 + Co2
SRS + 2H2O → sr (OH)2 + H2Siež
Môže vám slúžiť: kyselina síraChemická štruktúra a fyzikálno -chemické vlastnosti
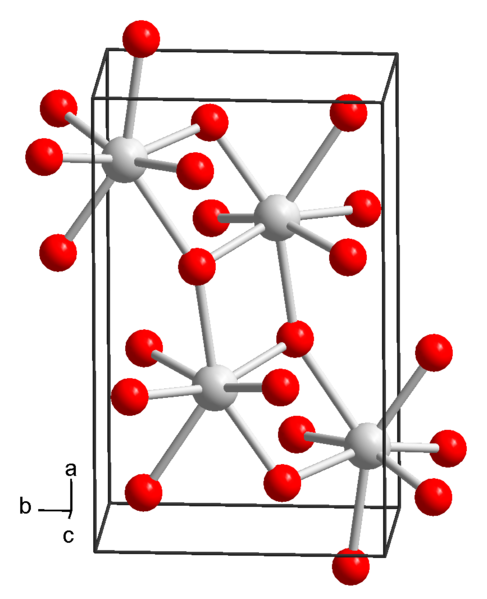 Chemická štruktúra hydroxidu stroncia. Zdroj: Wikimedia Commons
Chemická štruktúra hydroxidu stroncia. Zdroj: Wikimedia Commons V súčasnosti sú známe 3 formy hydroxidu stroncia: oktahydrát, monohydrát a bezvodý.
Októnovaný hydroxid strontium
Z roztokov v normálnych podmienkach teploty a tlaku (25 ° C a 1 atm) sa hydroxid strontium zráža oktahydrátom, ktorého chemický vzorec je SR (OH)2∙ 8h2Ani.
Táto zlúčenina má molárnu hmotnosť 265,76 g/mol, hustotu 1,90 g/cm a precipitáty ako tetragonálne kryštály (s priestorovou skupinou P4/NCC) kvadrangulárneho prizmatického vzhľadu a bezfarebného.
Podobne má hydroxid stronium Stront.
Monohydratovaný hydroxid strontium
Podľa štúdií optickej mikroskopie (vykonávané technikou difrakcie X -BRAY) zvýšením teploty na približne 210 ° C - konštantný atmosférický tlak - SR (OH)2∙ 8h2O Je dehydratovaný a transformovaný na monohydratovaný hydroxid strontium (SR (OH)2∙ h2Buď).
Táto forma zlúčeniny má molárnu hmotnosť 139,65 g/mol a jej teplota topenia je -73,15 ° C (375k). Vďaka svojej atómovej konfigurácii to predstavuje menšiu rozpustnosť vo vode, ako je opísané vo svojej oktahydrátovej forme.
Hydroxid strontium
Pokračovaním zvyšovania teploty systému na približne 480 ° C sa dehydratácia predĺži až do bezvodého hydroxidu na úsek.
Na rozdiel od svojich hydratovaných tvarov má molárnu hmotnosť 121,63 g/mol a hustotu 3 625 g/cm3. Jeho bod varu je dosiahnutý pri 710 ° C (1 310 ° F alebo 983 K), zatiaľ čo bod topenia je pri 535 ° C (995 ° F alebo 808 K).
Môže vám slúžiť: Ididio 192Rozpustnosť
Hydroxid strontium Octahydrát má rozpustnosť vo vode 0,91 gramov na 100 mililitrov (merané pri 0 ° C), zatiaľ čo jeho bezdôvodná forma v podobných teplotných podmienkach má rozpustnosť 0,41 gramov na 100 mililitrov.
Podobne sa táto látka považuje za nerozpustnú v acetóne a úplne rozpustná v kyselinách a chloridu amónneho.
Chemická reaktivita
Hydroxid strontium nie je horľavý, jeho chemická reaktivita zostáva stabilná pri miernych teplotách a tlakoch a je schopná absorbovať oxid uhličitý z atmosférického vzduchu a transformovať ho na uhličitan strontium.
Okrem toho je to ťažko dráždivá zlúčenina, ak sa dostanete do kontaktu s kožou, dýchacím traktom alebo inými sliznicami.
Používa hydroxid strontium
Vďaka svojim hygroskopickým charakteristikám a základným vlastnostiam sa hydroxid strontium používa pre rôzne aplikácie v priemysle:
- Extrakcia moice a rafinácia cukru z repy.
- Plastový stabilizátor.
- Tuky a mazivo.
Extrakcia Moice a rafinácia cukru repy
Na začiatku 21. storočia v Nemecku sa začal napínací hydroxid používať na rafináciu repy z repy, cez patentovaný proces Carl Scheibler v roku 1882.
Tento postup spočíva v zmesi hydroxidu stroncia a sladkej buničiny repy, čo vedie k nerozpustnému disacharidu. Tento roztok je oddelený dekantáciou a po vykonaní procesu rafinácie sa cukor získa ako konečný produkt.
Aj keď sa tento postup stále používa, existujú aj iné metódy s oveľa väčším dopytom po lacnejších, ktoré sa používajú v drvivej väčšine svetových cukorovacích rafinérií. Napríklad metóda barsil, ktorá používa kremičitan bária alebo metódu Steffen, s použitím vápna ako extraktorového činidla.
Môže vám slúžiť: anomérny uhlík: čo je, charakteristiky, príkladyStroncium
Sú to mazacie tuky, ktoré obsahujú hydroxid stroncia. Sú schopné silne dodržiavať povrchy s kovovými charakteristikami, sú odolné voči vode a podporujú náhle zmeny teploty.
Vďaka svojej dobrej fyzickej a chemickej stabilite sa tieto tuky používajú ako priemyselné mazivá.
Plastový stabilizátor
Prevažná väčšina plastov, ktoré sú vystavené klimatickým faktorom, ako je slnko, dážď a atmosférický kyslík, modifikujte svoje vlastnosti a degradujú.
Kvôli svojej značnej odolnosti proti vode sa k týmto polymérom pridáva hydroxid strontium - počas fúzie fúzie - pôsobiaci ako stabilizátor pri výrobe plastových výrobkov na predĺženie jeho životnosti.
Ostatné aplikácie
- V lakovnom priemysle sa používa ako základná prísadka na urýchlenie procesu sušenia v komerčných a priemyselných obrazoch.
- Z hydroxidu stroncia sa získajú soli alebo stronium iónov, ktoré sa používajú ako surovina na výrobu článkov pyrotechniky.
Odkazy
- Wikipedia (n.d.). Hydroxid strontium. Získaný z.Wikipedia.orgán
- Pubchem (s.F.). Hydroxid strontium. Získané z pubchem.Ncbi.NLM.NIH.Vláda
- Honeywell (s.F.). Oktahydrát hydroxidu. Zdroj: Honeywell.com

