Štruktúra, vlastnosti, nomenklatúra, nomenklatúra, použitia medeného hydroxidu (II)

- 657
- 102
- Valentín Dula
On Hydroxid medený (II) o cupric Hydroxid je zelenkavá modrá alebo modrá kryštalická anorganická pevná látka, ktorej chemický vzorec je Cu (OH)2. Získava sa ako modrá objemná zrazenina pridaním alkalického hydroxidu do roztokov Cupric (to znamená, že obsahujú ióny cu2+). Je to nestabilná zlúčenina.
Aby sa zvýšila jeho stabilita, je pripravená v prítomnosti amoniaku (NH3) alebo fosfáty.Ak sa pripravujete v prítomnosti amoniaku, existuje materiál s dobrou stabilitou a veľkou veľkosťou častíc.
 Vzorka Cupric Hydroxid, Cu (OH)2. Samzane v talianskej Wikipédii [verejná doména] Zdroj: Wikipedia Commons
Vzorka Cupric Hydroxid, Cu (OH)2. Samzane v talianskej Wikipédii [verejná doména] Zdroj: Wikipedia Commons Pri príprave s medeným fosfátom (II), Cu3(PO4)2, Získa sa jemnejšia veľkosť častíc a väčšia plocha povrchu. Kuprický hydroxid sa široko používa ako fungicíd a bakterici v poľnohospodárstve a na liečbu dreva, čím sa predĺži jeho životnosť.
Používa sa tiež ako doplnok potravín pre zvieratá. Používa sa ako surovina na získanie ďalších soli meďnatiny a galvanoplastiky na zakrytie povrchov.
Štúdie sa vykonávajú s cieľom odhadnúť ich potenciál bojovať proti bakteriálnym a plesňovým infekciám v ľudskej bytosti.
[TOC]
Štruktúra
Hydroxid medený (II) obsahuje nekonečné medené ióny (Cu2+) United pre hydroxylové skupiny (OH-).
Reťaze sú také balené, že 2 atómy kyslíka z iných reťazcov sú nad a pod každým atómom medi a potom prijímajú skreslenú oktaedrálnu konfiguráciu, ktorá je bežná vo väčšine medených zlúčenín (II).
Vo svojej štruktúre sú štyri atómy kyslíka vo vzdialenosti 1,93 A; Dva atómy kyslíka sú 2,63 A; A vzdialenosť Cu-Cu je 2,95 až.
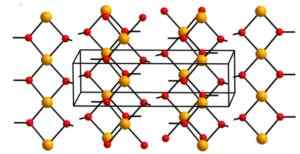 Kryštalická štruktúra hydroxidu. Aleksandar Kondinski [CC BY-SA.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikipedia Commons
Kryštalická štruktúra hydroxidu. Aleksandar Kondinski [CC BY-SA.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikipedia Commons Menovanie
- Hydroxid medený (II).
- Cupric hydroxid.
- Medený dihydroxid.
Vlastnosti
Fyzický stav
Kryštalický tuhý.
Molekulová hmotnosť
99,58 g/mol.
Bod topenia
Rozpadne sa pred topením. Bod degradácie 229 ° C.
Môže vám slúžiť: 25 príkladov rozpustnosti v každodennom životeHustota
3,37 g/cm3
Rozpustnosť
Je prakticky nerozpustný vo vode: 2,9 mikrogramov/l A 25 ° C. Rýchlo rozpustné v kyselinách, v koncentrovaných alkalických roztokoch a hydroxidu amónneho. Nerozpustné v organických rozpúšťadlách. V horúcej vode rozkladá generujúci oxid medi (II), ktorý je stabilnejší.
Ďalšie vlastnosti
Je ľahko rozpustný v silných kyselinách a tiež v alkalických koncentrovaných roztokoch hydroxidov, aby poskytoval tmavo modré anióny, pravdepodobne typ [cun(Oh)2n+2]2-.
Jeho stabilita závisí od metódy prípravy.
Môže sa rozbiť tým, že poskytne oxid meďnatého (II) čierna (CUO), ak zostane v pokoji niekoľko dní alebo nízke zahrievanie.
V prítomnosti nadbytku alkaliho sa rozkladá nad 50 ° C.
Žiadosti
V poľnohospodárstve
Hydroxid medený (II) má širokú aplikáciu ako fungicíd a antibakteriálne v poľnohospodárskych plodinách. Tu je niekoľko príkladov:
- Slúži proti bakteriálnym škvrnám ( Erwinia) V šaláte, uplatňovanie ako ošetrenie listom.
- Proti bakteriálnym škvrnám (z Xanthomonas pruni) V broskyniach, na ktoré sa uplatňuje latentné a listové ošetrenie.
- Používa sa proti hárku a stonke čučoriedok prostredníctvom latentných aplikácií.
- Proti hnilobe počas skladovania čučoriedok spôsobených Monilinia oxycocci, latentnou aplikáciou.
Na aplikáciu v poľnohospodárstve sa používa medený hydroxid (II), ktorý sa pripravuje v prítomnosti fosfátov v dôsledku svojej malej veľkosti častíc.
 Kultivácia šalátu. Zdroj: Pixabay
Kultivácia šalátu. Zdroj: Pixabay Pri uchovávaní dreva
Drevo z dôvodu organickej povahy je citlivé na útok hmyzu a mikroorganizmov. Hydroxid medený (II) sa používa ako biocíd pre huby, ktoré útočia na drevo.
Zvyčajne sa používa vedľa kvartérnej amónnej zlúčeniny (NH4+). Hydroxid medený pôsobí ako fungicíd a zlúčenina kvartérnej amónium funguje ako insekticíd.
Týmto spôsobom ošetrené drevo vydrží alebo odoláva servisným podmienkam a dosiahne požadovanú úroveň výkonu používateľa. Drevo ošetrené týmito zlúčeninami má však vysokú hladinu medi a je veľmi korozívne pre spoločnú oceľ, takže je potrebný typ nehrdzavejúcej ocele, ktorý môže vydržať spracovanie ošetreného dreva.
Môže vám slúžiť: RETVERNA REAKCIA: Charakteristiky a príkladyNapriek svojej užitočnosti sa medený hydroxid (II) považuje za mierne nebezpečný biocíd.
Z tohto dôvodu existuje obava, že sa uvoľňuje z dreva ošetreného do životného prostredia v množstvách, ktoré môžu byť škodlivé pre mikroorganizmy, ktoré sú prirodzene prítomné vo vodách (rieky, jazerá, mokrade a more) alebo pre pôdu.
Vo výrobe Rayón
Od devätnásteho storočia sa na rozpustenie celulózy použili amoniaálne roztoky medi hydroxidu (II). Toto je jeden z prvých krokov na získanie vlákna s názvom Rayón prostredníctvom technológie vyvinutej Bembergom v Nemecku.
Meďný hydroxid (II) sa rozpustí v roztoku amoniaku (NH3), tvorenie zložitej soli.
Krátke rafinované bavlnené vlákna sa pridávajú do roztoku amoniakálneho medi obsahujúceho medený hydroxid (II) vo forme zrazeného tuhého.
Bavlnená celulóza tvorí komplex s rozpúšťaním hydroxidu medi tetra-amonium v roztoku.
Následne je týmto riešením Coagula pri prechádzaní extrúznym zariadením.
Vďaka svojim vysokým nákladom bola táto technológia už prekonaná technológiou Viscosa. Technológia Bemberg sa v súčasnosti používa iba v Japonsku.
V priemysle potravín pre zvieratá
Používa sa ako stopy v krmive pre zvieratá, pretože je jednou z látok potrebných ako mikroživiny pre úplnú výživu zvierat.
 Koncentrované jedlo pre hovädzí dobytok. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons
Koncentrované jedlo pre hovädzí dobytok. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons Je to tak preto, že u medi s vyšším živým bytostiam je nevyhnutným prvkom, ktorý sa vyžaduje pre aktivitu rôznych enzýmov obsahujúcich meď.
Napríklad je obsiahnutý v enzýme, ktorý sa okrem iného podieľa na výrobe kolagénu a enzýmu potrebného na syntézu melanínu.
Môže vám slúžiť: amínyJe to zlúčenina všeobecne uznávaná ako poistenie, keď sa pridáva do úrovní v súlade s dobrou potravinovou praxou.
 Mliečne kravy. Zdroj: Pixabay
Mliečne kravy. Zdroj: Pixabay Pri výrobe iných medených zlúčenín (II)
Prekurzor aktívny pri výrobe nasledujúcich zlúčenín medi (II): meď (II), 2-otylhexanoátovo meď (II) a mydlá meďnatého a mydlá meďnatého. V týchto prípadoch sa používa medený hydroxid (II), ktorý je syntetizovaný v prítomnosti amoniaku.
Iné použitia
Používa sa pri stabilizácii nylonu v elektródach batérií; ako farebný fixér v operáciách farbenia; ako pigment; v insekticídoch; pri ošetrení a zafarbení papiera; v katalyzátoroch, ako katalyzátor vo vulkanizácii polysulfidového gumy; ako anti -sniffing pigment; a pri elektrolýze, v galvanoplastike.
Budúce lekárske aplikácie
Hydroxid medený (II) je súčasťou medených zlúčenín, ktoré sa študujú vo forme nanočastíc na elimináciu baktérií, ako sú napríklad A. coli, Klimatizovať. pneumoniae, p. Aeruginosa, Salmonella spp., okrem iného, príčiny chorôb v ľudskej bytosti.
Zistilo sa tiež, že nanočastice medi môžu byť účinné proti Candida albicans, Huba, ktorá je bežnou príčinou ľudských patológií.
To naznačuje, že nanotechnológia medi môže hrať dôležitú úlohu proti baktériám a húb spôsobujúcim ľudské infekcie a hydroxid medi (II) môže byť v týchto oblastiach veľmi užitočný.
Odkazy
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Zväzok 7. Štvrté vydanie. John Wiley & Sons.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. Zväzok A7. VCH Verlagsgellschaft MBH.
- Tanec, J.C.; Emeléus, h.J.; Sir Ronald Nyholm a Trotman-Deckenson,.F. (1973). Komplexná anorganická chémia. Zväzok 3. Pergamón.
- Lekárska knižnica. (2019). Medený (ii) hydroxyd. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Schiopu, n. a Tiruta-Brana, L. (2012). Konzervačné látky. V toxicite tlmivých materiálov. Kapitola 6. Zotavené z vedeckých pracovníkov.com.
- Mordorski, B. a Friedman,. (2017). Kovové nanočastice na mikrobiálnu infekciu. Vo funkcionalizovaných nanomateriáloch na liečbu mikrobiálnej infekcie. Kapitola 4. Zotavené z vedeckých pracovníkov.com.
- Takashi Tsurumi. (1994). Roztok. V technológii pokročilých vlákien. Kapitola 3. Zotavené z vedeckých pracovníkov.com.
- « Histochemistry Foundation, spracovanie, farbenie
- Štruktúra oxidu cerio (IV), vlastnosti, použitie »

