Hydroxid bária (BA (OH) 2)

- 1010
- 78
- JUDr. Rudolf Čapkovič
 Hydroxid bária sa používa na rôzne účely v rôznych odvetviach. S licenciou
Hydroxid bária sa používa na rôzne účely v rôznych odvetviach. S licenciou Čo je bárne hydroxid?
On hydroxid bária Je to chemická zlúčenina vzorca ba (OH)2(H₂o)X. Je to silná základňa a môže byť vo forme bezvodého, monohydrátu alebo okohydrátu. Monohydratovaná forma, tiež nazývaná Barita Agua, je najbežnejším a komerčným použitím.
Hydroxid bária sa môže pripraviť rozpustením oxidu bárnatého (BAO) vo vode: bao + 9H2O → BA (OH)2· 8h2Ani. Kryštalizuje ako oktahydrát, ktorý sa pri zahrievaní vo vzduchu stáva monohydrátom. Pri prázdnom 100 ° C bude monohydrát produkovať bao a vodu.
Vlastnosti hydroxidu bária
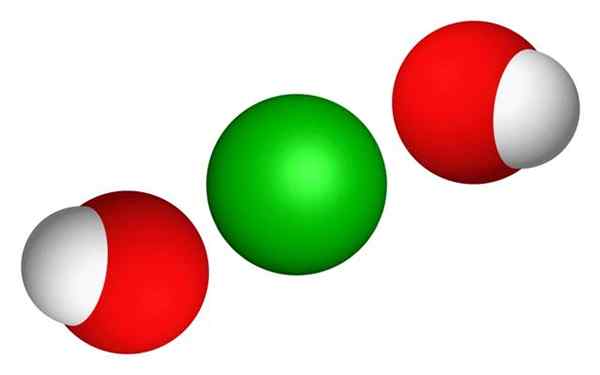 3D chemická štruktúra hydroxidu bária. Verejná doména, Wikimedia Commons.
3D chemická štruktúra hydroxidu bária. Verejná doména, Wikimedia Commons. - Hydroxid báriu sú biele alebo priehľadné oktahédické kryštály. Chýbajúca vôňa a žieravá príchuť.
- Tvar anhydry má molekulovú hmotnosť 171,34 g/mol, hustotu 2,18 g/ml, fúzny bod 407 ° C a bod varu 780 ° C.
- Monohydrovaný tvar má molekulovú hmotnosť 189 355 g/mol, hustotu 3 743 g/ml a 300 ° C bod na topenie.
- Tvar októdratu má molekulovú hmotnosť 315,46 g/mol, hustotu 2,18 g/ml a 78 ° C bod topenia.
- Zlúčenina je mierne rozpustná vo vode a nerozpustná v acetóne. Je to silný základ s PKA 0,15 a 0,64 pre prvý a druhý OH- respektíve.
- Hydroxid bária reaguje podobne ako hydroxid sodný (NaOH), ale je menej rozpustný vo vode.
- Neutralizuje exotermicky kyseliny za vzniku solí viac vody.
- Môže reagovať s hliníkom a zinkom za vzniku oxidov kovov alebo hydroxidov a generovať plynný vodík.
- Môžete začať polymerizačné reakcie v polymerizovateľných organických zlúčeninách, najmä epoxies.
- Môže vytvárať horiace a/alebo toxické plyny s amónnymi soľami, dusičnanmi, halogénovanými organickými zlúčeninami, rôznymi kovmi, peroxidmi a hydroperoxidmi. Chlórované gumové zmesi explodujú, keď sú zahrievané alebo rozdrvené.
Môže vám slúžiť: zriedené riešenie- Hydroxid bária sa rozpadne na oxid bárnatého, keď sa zahrieva pri 800 ° C. Reakcia oxidu uhličitého produkuje uhličitan bária. Jeho vodný roztok, vysoko alkalický, prežíva neutralizačné reakcie s kyselinami. Teda síran bária a fosforečnan fosforečnanu s kyselinami sulfurských a fosforečných.
H2SW4 + Ba (oh)2 Baso4 + 2h2Ani
- Reakcia sulfidu vodíka produkuje sulfid bária. Zrážky mnohých nerozpustných bárňovacích solí alebo menej rozpustných, môžu byť výsledkom reakcie s dvojitou náhradou, keď sa vodný roztok hydroxidu bária sa zmieša s mnohými roztokmi z iných kovových solí.
- Zmes tuhého hydratovaného hydroxidu s tuhým amonickým chloridom v kadičke vytvára endotermickú reakciu na výrobu kvapaliny s vývojom amoniaku. Teplota dramaticky klesá na približne -20 ° C.
Ba (oh)2 (s) + 2nh4CL (s) → bacl2 (aq) + 2nh3 g) + h2Ani
- BA (OH) 2 reaguje s oxidom uhličitým za výrobu uhličitanu bárnatého. Toto je vyjadrené nasledujúcou chemickou reakciou:
BA (OH) 2 + CO2 → BaCO3 + H2O.
Reaktivita a nebezpečenstvo
Hydroxid bária je klasifikovaný ako stabilná zlúčenina, ktorá nie je v poriadku, ktorá reaguje rýchlo a exotermicky s kyselinami, je nekompatibilná s oxidom uhličitým a vlhkosťou. Zlúčenina je toxická a ako silná báza je korozívna.
Vdýchnutie, požitie alebo kontakt s kožou s materiálom môžu spôsobiť vážne zranenia alebo smrť. Kontakt s roztavenou látkou môže spôsobiť vážne popáleniny pokožky a očí.
Účinky kontaktu alebo vdýchnutia sa môžu oneskoriť. Oheň môže produkovať dráždivé, korozívne a/alebo toxické plyny. Wastewater na kontrolu požiaru môže byť korozívna a/alebo toxická a spôsobuje kontamináciu.
Môže vám slúžiť: kyslé soli (oxizály)Očný kontakt
Ak sa zlúčenina dostane do kontaktu s očami, musia sa skontrolovať a odstrániť kontaktné šošovky. Oči s veľkým množstvom vody najmenej 15 minút, so studenou vodou by sa mali okamžite premyť.
Kontakt s kožou
V prípade kontaktu kože musí byť postihnutá oblasť okamžite prepláchnutá najmenej 15 minút s množstvom.
Predtým, ako ich znova použijete, umyte oblečenie a topánky. Ak je kontakt vážny, umyte sa dezinfekčným mydlom a zakryte pokožku kontaminovanú antibakteriálnym krémom.
Vdýchnutie
V prípade vdýchnutia sa obeť musí preniesť na čerstvé miesto. Ak nedýchate, podáva sa umelé dýchanie. Ak je dýchanie ťažké, poskytnite kyslík.
Požitie
Ak sa zlúčenina požije, zvracanie by sa nemalo indukovať. Voľné tesné oblečenie, ako je krk na košeľu, opasok alebo kravata.
Vo všetkých prípadoch je potrebné získať okamžitú lekársku starostlivosť.
Žiadosti
1. Priemysel
- Hydroxid bária sa používa ako predchodca iných zlúčenín bária. Monohydrát sa používa na dehydratáciu a eliminovanie sulfátu z rôznych výrobkov. Táto priemyselná aplikácia sa vzťahuje aj na laboratórne použitie.
- Používa sa ako prísada v termoplastickej (ako sú fenolové živice), rayónov a stabilizátory PVC na zlepšenie plastických vlastností. Tento materiál sa používa ako všeobecná prísada použitia pre mazivá a tuky.
- Medzi ďalšie priemyselné aplikácie patrí výroba cukru, mydlá, zubonifikácia tukov, fúzia kremičitanov a chemická syntéza iných zlúčenín bária a organických zlúčenín.
2. Laboratórium
- Používa sa v analytickej chémii na titráciu slabých kyselín, najmä organických kyselín. Je zaručené, že jeho priehľadný vodný roztok neobsahuje uhličitany, na rozdiel od hydroxidu sodného a hydroxidu draselného, pretože uhličitan bária je vo vode nerozpustný.
Môže vám slúžiť: Špeciálne zlúčeniny: Charakteristiky, školenie, použitiaTo vám umožní používať ukazovatele, ako je fenolftaleín alebo timoftaleín (so zmenami alkalických farieb) bez rizika chybov titrácie spôsobených prítomnosťou uhličitanových iónov, ktoré sú oveľa menej základné.
- Používa sa občas v organickej syntéze ako silný základ, napríklad na hydrolýzu esterov a nitrilov.
- Používa sa tiež pri dekarboxylácii aminokyselín, ktoré uvoľňujú uhličitan bárnat.
- Používa sa tiež na prípravu cyklopentanónu, alkoholu diacetón a gama-laktónu D-Gulonic.
3. Katalyzátor reakcie Wittig-Horner
Reakcia Wittig-Horner, známa tiež ako Horner-Wadsworth-Emmons (alebo HWE reakcia), je chemická reakcia používaná v organickej chémii na stabilizáciu fosfonátových karbaniónov s aldehydmi (alebo ketónmi) na výrobu prevažne E-alqueos (trans-tranzit).
Soncochochemická reakcia sonkochochemickej reakcie Wittig je katalyzovaná aktivovaným hydroxidom bária a vykonáva sa za podmienok rozhrania tuhej kvapaliny.
Proces Soncoquímico sa uskutočňuje pri izbovej teplote a s nižšou hmotnosťou katalyzátora a reakčným časom ako tepelný proces. Za týchto podmienok sa získajú výťažky podobné výnosom tepelného procesu.
Analyzuje sa povaha aktívneho miesta katalyzátora, ktorý pôsobí v tomto procese. Mechanizmus navrhuje proces SonCoquímiCo.
4. Iné použitia
Hydroxid báriu má ďalšie použitia, napríklad:
- Výroba alkálie.
- Konštrukcia skla.
- Vulkanizácia syntetickej gumy.
- Inhibítory korózie.
- Ako vŕtacie tekutiny, pesticídy a mazivo.
- Pre nápravu kotla.
- Na vylepšenie zeleninových a živočíšnych olejov.
- Na čerstvú farbu.
- Zmäkčenie vody.
- Ako zložka homeopatických liekov.
- Na čistenie kyseliny.
- Používa sa tiež v cukrovom priemysle na prípravu cukru repy.
- Konštrukčné materiály.
- Elektrické a elektronické výrobky.
- Pôdne povlaky.
Odkazy
- Hydroxid bária (s.F.). Zotavené z chemického.com.
- Hydroxid bária (s.F.). Zotavené z chemicialland21.com.

