Hydrolýza, čo pozostáva a príklady reakcií
- 4957
- 71
- Denis Škriniar
Ten hydrolýza Je to chemická reakcia, ktorá sa môže vyskytnúť u anorganických aj organických molekúl alebo iónov, a ktorá zahŕňa účasť vody na rozklad jej väzieb. Jeho meno pochádza z gréckeho, „vodného“ vody a „lýzy“ prasknutia.
Molekula vody, h2Alebo stanovuje rovnováhu s iónmi kyslých solí a slabých základov, ktoré sa prvýkrát objavujú tento koncept vo všeobecných štúdiách chémie a analytickej chémie. Je preto jednou z najjednoduchších chemických reakcií.
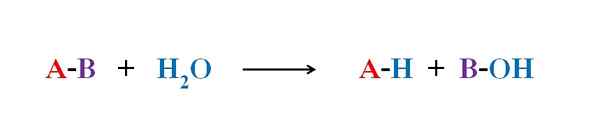 Všeobecná rovnica pre hydrolýznu reakciu. Zdroj: Gabriel Bolívar.
Všeobecná rovnica pre hydrolýznu reakciu. Zdroj: Gabriel Bolívar. V niekoľkých príkladoch hydrolýzy samotná voda nedokáže prelomiť určitú kovalentnú väzbu. Ak k tomu dôjde, proces zrýchľuje alebo katalyzuje okyslením alebo alkalizáciou média; to znamená v prítomnosti H iónov3Ani+ alebo oh-, respektíve. Existujú tiež enzýmy, ktoré katalyzujú hydrolýzu.
Hydrolýza zaberá osobitné miesto z hľadiska biomolekúl, pretože prepojenia, ktoré udržujú svoje monoméry pohromade, sú za určitých podmienok náchylné na hydrolyzar. Napríklad cukry sa hydrolyzujú, aby sa rozložili polysacharidy vo svojich zložkových monosacharidoch vďaka pôsobeniu glukozidázových enzýmov.
[TOC]
Čo je hydrolýza?
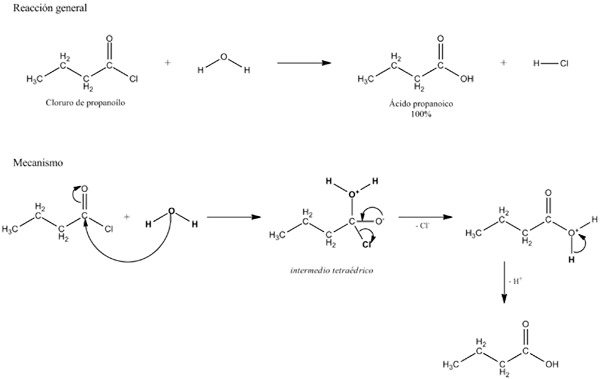
Horný obrázok vysvetľuje, z čoho hydrolýza pozostáva. Všimnite si, že ich spojenie prelomí nielen molekula alebo substrát (ak sprostredkujú enzýmy), ale aj samotnú vodu, ktorá je „zlomenou“ v H+ a oh-, Kde h+ končí A a Oh- s B. A-B reaguje s molekulou vody, ktorá pochádza z dvoch produktov, A-H a B-OH.
Hydrolýza je preto reakciou v rozpore s kondenzáciou. V kondenzácii sú dva produkty, ktoré povedzme A-H a B-OH, viažu uvoľnenie malej molekuly: voda. Pri hydrolýze sa konzumuje molekula, zatiaľ čo v kondenzácii sa uvoľňuje alebo vyrába.
Môže vám slúžiť: Carbonyl Group: Charakteristiky, vlastnosti, nomenklatúra, reaktivitaVráťte sa k príkladu cukrov, predpokladajme, že A-B zodpovedá diméru sacharózy, kde predstavuje glukózu a b fruktózu. A-B, glukozidické spojenie môže hydrolyzarizovať, aby vznikli dva monosacharidy osobitne a v roztoku, a to isté sa deje s oligom a polysacharidmi, ak sprostredkujú enzýmy v takýchto reakciách.
Všimnite si, že v tejto reakcii má šípka A-B iba jednu adresu; to znamená, že je to nezvratná hydrolýza. Mnoho hydrolýzy sú však v skutočnosti reverzibilné reakcie, ktoré dosahujú rovnováhu.
Príklady hydrolytických reakcií
- ATP
ATP je stabilný medzi hodnotami pH 6,8 a 7,4. Avšak pri extrémnych hodnotách pH je spontánne hydrolyzovaný. U živých bytostí je hydrolýza katalyzovaná enzýmami známymi ako Atasas:
ATP +H2O => ADP +PI
Táto reakcia je silne exergonická, pretože entropia ADP je väčšia ako ATP. Variácia voľnej energie Gibbs (Agº) je - 30,5 kJ/mol. Energia produkovaná hydrolýzou ATP sa používa v mnohých endergonských reakciách.
Spojené reakcie
V niektorých prípadoch sa hydrolýza ATP používa na konverziu zlúčeniny v zlúčenine (B).
A +ATP +H2Alebo b +adp +pi +h+
- Vodná voda
Dve molekuly vody môžu navzájom reagovať pri zjavnej hydrolýze:
H2Alebo + h2Alebo h3Ani+ + Oh-
Je to, akoby jedna z týchto molekúl vody zlomila v h+ a oh-, idem prepojiť H+ Do atómu kyslíka inej molekuly vody, ktorý spôsobuje hydrium ión, h3Ani+. Táto reakcia, viac ako hydrolýza, sa týka sebapopotolýzy vody.
Môže vám slúžiť: aktivačná energia- Bielkovina
Proteíny sú stabilné makromolekuly a na dosiahnutie ich úplnej hydrolýzy v aminokyselinách, ktoré ich tvoria, sú potrebné extrémne podmienky; ako je koncentrácia kyseliny chlorovodíkovej (6 m) a vysoké teploty.
Živé bytosti sú však obdarené enzymatickým arzenálom, ktorý umožňuje hydrolýzu proteínov v aminokyselinách v duodenu. Enzýmy zapojené do trávenia proteínov sú takmer úplne vylučované pankreasom.
Existujú exopeptidázové enzýmy, ktoré degradujú proteíny, počnúc ich koncami: aminopeptidáza cez amino -koniec a karboxypeptidáza cez karboxylovú konc. Endopeptidázové enzýmy vyvíjajú svoj účinok vo vnútri proteínového reťazca, napríklad: Tripsín, pepsín, chimotripsín atď.
- Amidas a estery
Amidy, keď sa zahrievajú v alkalickom médiu, pochádzajú z karboxylovej kyseliny a amínu:
Rcconh2 + H2O => rcoo- + NH2
Utiepenia vo vodnom médiu sú hydrolyzované v kyseline karboxylovej a alkoholu. Proces je katalyzovaný buď základňou alebo kyselinou:
Rco-alebo ' +h2O => rcoOH +r'OH
Toto je slávna zubonifikačná reakcia.
- Kyslá báza
Vo vode sa niekoľko druhov hydrolyzuje na okyslenie alebo alkalizáciu vodného prostredia.
Pridanie základnej soli
Octanu sodný, základná soľ, disociuje sa vo vode a dáva ióny na ióny+ (sodík) a Cho3Coo- (acetát). Jeho základnosť je, že acetát je hydrolyzovaný na generovanie iónov OH-, zatiaľ čo sodík zostáva nezmenený:
Chvály3Coo- + H2Alebo CH3COOH +OH-
Môže vám slúžiť: metyl salicylátOh- Je zodpovedný za pH, aby sa zvýšil a stal sa základným.
Pridanie kyslej soli
Chlorid amónny (NH4Cl) je tvorený chloridovým iónom (Cl-) z kyseliny chlorovodíkovej (HCI), silnej kyseliny a katiónu amónneho (NH4+) z hydroxidu amónneho (NH4Och), slabá základňa. Cl- Nevystáva sa vo vode, ale katión amónneho sa transformuje do vody nasledujúcim spôsobom:
NH4+ + H2Alebo NH3 + H3Ani+
Hydrolýza katiónu amónneho vytvára protóny, ktoré zvyšujú kyslosť vodného média, takže sa dospelo k záveru, že NH4CL je kyslá soľ.
Pridanie neutrálnej soli
Chlorid sodný (NaCl) je soľný produkt reakcie silnej bázy (NaOH) so silnou kyselinou (HCI). Pri rozpustení chloridu sodného vo vode sa vyrába katión sodný (NA+) a anión (cl-). Oba ióny sa vo vode nerozlišujú, takže nepridávajú h+ alebo oh-, Udržujte svoje pH konštantné.
Preto sa hovorí, že chlorid sodný je neutrálna soľ.
Odkazy
- Mathews, C. Klimatizovať., Van Holde, K. A. A Ahern, K. G. (2002). Biochémia. (Tretia edícia). Upraviť. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- HelMestine, Anne Marie, PH.D. (13. januára 2019). Hydrolýza: Definícia a príklad. Zotavené z: Thoughtco.com
- Theresa Phillips. (28. apríla 2019). Vysvetlenie procesu hydrolýzy. Získané z: Thebalance.com
- Redaktori Enyclopaedia Britannica. (16. novembra 2016). Hydrolýza. Encyclopædia Britannica. Získané z: Britannica.com
- Wikipedia. (2019). Hydrolýza. Zdroj: In.Wikipedia.orgán
- « Charakteristiky hyrakotheria, výživa, druh, reprodukcia
- HISTÓRIA Origins Videohry do virtuálnej reality »

