História vodíka, štruktúra, vlastnosti a použitie

- 883
- 238
- JUDr. Rudolf Čapkovič
On vodík Je to chemický prvok, ktorý predstavuje symbol H. Jeho atóm je najmenší zo všetkých a je to, s ktorým sa začína periodický stôl, bez ohľadu na to, kde je umiestnený. Pozostáva z bezfarebného plynu zloženého z diatomických molekúl H2, a nie pre izolované atómy H; Rovnako ako v prípade ušľachtilých plynov, aj on, AR,.
Zo všetkých prvkov je to pravdepodobne najpriamejšie a najdôležitejšie, nielen pre svoje vlastnosti v suchozemských alebo drastických podmienkach, ale aj pre jeho obrovské množstvo a rozmanitosť jeho zlúčenín. Vodík je plyn, hoci je inertný v neprítomnosti požiaru, horľavý a nebezpečný; Zatiaľ čo voda, h2Alebo je to univerzálne rozpúšťadlo a život.
 Červené valce používané na skladovanie vodíka. Zdroj: Famartin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Červené valce používané na skladovanie vodíka. Zdroj: Famartin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Samotný vodík nevykazuje žiadnu vizuálnu zvláštnosť, ktorá stojí za obdivovanie, jednoducho je plyn, ktorý je uložený v červených valcoch alebo nábojoch. Sú to však jeho vlastnosti a schopnosť prepojiť sa so všetkými prvkami, ktoré sa vracia k špeciálnemu vodíku. A to všetko, aj keď má iba elektrón z Valencie.
Ak vodík nie je uložený vo svojich valcoch, unikol by priestoru, zatiaľ čo veľká časť reaguje na výstup. A aj keď má veľmi nízku koncentráciu vo vzduchu, ktorý dýchame, mimo Zeme a vo zvyšku vesmíru, je to najhojnejší prvok, je v hviezdach a považuje sa za svoju stavebnú jednotku.
Na zemi, na druhej strane, predstavuje asi 10% z jej celkovej hmoty. Aby som to vizualizoval, čo to znamená, malo by sa uvažovať o tom, že povrch planéty je prakticky pokrytý oceánmi a že vodík sa nachádza v mineráloch, v ropnom oleji a v akejkoľvek organickej zlúčenine, okrem toho, že je súčasťou všetkých živých bytostí.
Rovnako ako uhlík, všetky biomolekuly (uhľohydráty, proteíny, enzýmy, DNA atď.) Majú atómy vodíka. Preto existuje veľa zdrojov na ich extrahovanie alebo produkciu; Málokto však predstavuje skutočne ziskové výrobné metódy.
[TOC]
História
Identifikácia
Aj keď v roku 1671 Robert Boyle bol prvýkrát svedkom plynu, ktorý sa vytvoril, keď železné spisy reagovali s kyselinami, bol britským vedcom Henrym Cavendishom v roku 1766, ktorý ho identifikoval ako novú látku; „Horľavý vzduch“.
Cavendish zistil, že keď sa tento údajný horiaci vzduch spálil, voda sa vytvorila. Na základe svojej práce a výsledkov dal francúzsky chemik Antoine Lavoisier tento plyn v roku 1783 názov vodíka. Etymologicky jeho význam pochádza z gréckych slov „hydro“ a „gény“: vodný formátor.
Elektrolýza a palivo
Krátko nato v roku 1800 americkí vedci William Nicholson a Sir Anthony Carlisle zistili, že voda sa môže rozkladať na vodík a kyslík; našiel elektrolýzu vody. Následne, e 1838, švajčiarsky chemik Christian Friedrich Schoenbein zaviedol myšlienku využitia výhod spaľovania vodíka na výrobu elektriny.
Popularita vodíka bola natoľko, že dokonca aj spisovateľ Julio Verne vo svojej knihe označoval palivo budúcnosti Tajomný ostrov (1874).
Izolácia
V roku 1899 bol škótsky chemik James Dewar prvý, kto izoloval vodík ako skvapalnený plyn, ktorý bol sám sebou, ktorý by ho mohol dosť ochladiť, aby ho získal vo svojej pevnej fáze.
Dva kanály
Z tohto bodu predstavuje história vodíka dva kanály. Na jednej strane jeho vývoj v oblasti palív a batérií; A na druhej.
Elektronická štruktúra a konfigurácia
 Diatomická molekula vodíka. Zdroj: Benjah-Bmm27 [verejná doména]
Diatomická molekula vodíka. Zdroj: Benjah-Bmm27 [verejná doména] Atómy vodíka sú veľmi malé a sotva majú elektrón na vytvorenie kovalentných väzieb. Keď sa spoja dva z týchto atómov, vedú k diatomickej molekule, h2; Toto je molekulárny vodík plynu (vynikajúci obraz). Každá biela guľa zodpovedá jednotlivému atómu H a globálnej sfére molekulárnym orbitálom.
Vodík teda skutočne pozostáva z molekúl H2 Veľmi malé, ktoré interagujú cez londýnske disperzné sily, pretože im chýba dipólový moment za to, že sú homonuklear. Preto sú veľmi „nepokojné“ a rýchlo sa šíria vo vesmíre, pretože neexistujú žiadne silné intermolekulárne sily, ktoré ich spomaľujú.
Elektronická konfigurácia vodíka je jednoducho 1s1. Tento orbitál, 1S, je produktom rozlíšenia slávnej Schrödingerovej rovnice pre atóm vodíka. V h2 Dva orbitály 1 1S sa prekrývajú za vzniku dvoch molekulárnych orbitálov: jeden z Link a druhý z Antienlace, podľa molekulárnej orbitálnej teórie (Tom).
Tieto orbitály umožňujú alebo vysvetľujú existenciu H iónov2+ alebo h2-; Chémia vodíka je však za normálnych podmienok definovaná podľa H2 alebo ióny h+ alebo h-.
Oxidácia
Z elektronickej konfigurácie pre vodík, 1s1, Je veľmi ľahké predpovedať jeho možné oxidačné čísla; Majte na pamäti, že orbitálne 2 s väčšou energiou nie sú k dispozícii pre chemické väzby. V bazálnom stave má teda vodík oxidačné číslo 0, h0.
Môže vám slúžiť: nikel hydroxid (ii): štruktúra, vlastnosti, použitia, rizikáAk stratíte jediný elektrón, orbitál 1S je prázdny a vytvára sa katión alebo vodíkový ión, h+, veľkej mobility takmer v akomkoľvek kvapalnom médiu; najmä voda. V tomto prípade je jeho oxidačné číslo +1.
A keď sa stane opak, to znamená, že vyhrá elektrón, orbitál bude mať teraz dva elektróny a bude 1s2. Potom je oxidačné číslo -1 a zodpovedá hydridnému aniónu, h-. Stojí za zmienku, že h- Je izolektronický až vznešený héliový plyn, on; to znamená, že oba druhy majú rovnaký počet elektrónov.
V súhrne je čísla oxidácie vodíka: +1, 0 a -1 a molekula H2 počíta sa, akoby mali dva atómy vodíka h0.
Fáza
Obľúbenou fázou vodíka, aspoň v pozemských podmienkach, je sóda, z dôvodov, ktoré boli predtým uvedené. Keď sa však teploty znižujú v poradí -200 ° C alebo ak tlak zvyšuje stovky tisíckrát ako atmosférický, vodík môže kondenzovať alebo kryštalizovať v kvapalnej alebo tuhej fáze.
Za týchto podmienok molekuly h2 Môžu sa vyrovnať s rôznymi spôsobmi definovania štrukturálnych vzorov. Londýnske disperzné sily sa teraz stávajú veľmi smerovými, a preto sa objavia geometrie alebo symetrie prijaté rovesníkmi2.
Napríklad dva HSSES H2, Je to ako písať (h2)2 Definujte symetrický alebo asymetrický štvorec. Medzitým tri páry h2, alebo (h2)3 Definujú šesťuholník, veľmi podobné ako uhlíkom v grafitových kryštáloch. V skutočnosti je táto hexagonálna fáza hlavnou alebo najstabilnejšou pre pevný vodík.
Ale čo keby tuhá látka nebola zložená z molekúl, ale z H? Potom by sme sa zaoberali kovovým vodíkom. Tieto atómy H, ktoré si pamätajú biele gule, môžu definovať tekutú fázu aj kovovú pevnú látku.
Vlastnosti
Fyzický vzhľad
Vodík je bezfarebný, bez zápachu a bez chuti. Preto, ak dôjde k úniku, predstavuje riziko výbuchu.
Bod varu
-253 ° C.
Bod topenia
-259 ° C.
Zapaľovací bod a stabilita
Prakticky exploduje pri akejkoľvek teplote, ak je v blízkosti plynu iskra alebo zdroj tepla, dokonca aj slnečné svetlo môže strieľať vodík. Pokiaľ je však dobre uložený, je to trochu reaktívny plyn.
Hustota
0,082 g/l. Je 14 -krát ľahší ako vzduch.
Rozpustnosť
1,62 mg/l pri 21 ° C vo vode. Vo všeobecnosti je vo väčšine tekutín nerozpustný.
Tlak vodnej pary
1,24 · 106 mmHg pri 25 ° C. Táto hodnota poskytuje predstavu o tom, ako musia byť uzavreté vodíkové valce, aby zabránili uniknutiu plynu.
Teplota
560 V ° C.
Elektronegativita
2.20 na stupnici Pauling.
Spaľovacie teplo
-285,8 kJ/mol.
Odparovanie
0,90 kJ/mol.
Fúzne teplo
0,117 kJ/mol.
Izotopy
„Normálny“ atóm vodíka je protio, 1H, ktorý predstavuje okolo 99,985% vodíka. Ďalšími dvoma izotopmi pre tento prvok sú deutérium, 2H a trícium, 3H. Tieto sa líšia v počte neutrónov; Deutérium má neutrón, zatiaľ čo Tritio má dva.
Chrbtice izoméry
Existujú dva typy molekulárneho vodíka, h2: Ortho a pre. V prvom dvom točeniam (protónu) atómov H sú orientované do rovnakého smeru (sú rovnobežné); Zatiaľ čo v druhom je tieto dve točenia v opačných smeroch (sú antiparalelné).
Vodík je najstabilnejší z týchto dvoch izomérov; Ale zvýšením teploty, orto vzťah: stať. Pri veľmi nízkych teplotách (vzdialene blízko absolútneho nuly, 20k), čistý vodík-pre.
Menovanie
Nomenklatúra odkazovať na vodík je jednou z najjednoduchších; Aj keď to nie je rovnaký spôsob pre ich anorganické alebo organické zlúčeniny. H2 Môže sa nazvať s nasledujúcimi názvami okrem „vodíka“:
-Molekulárny vodík
-Dihydrogén
-Diatomická molekula vodíka.
Pre ión h+ Ich názvy sú protónový alebo vodíkový ión; A ak je vo vodnom médiu, h3Ani+, Katión. Zatiaľ čo ión h- Je to hydrid anión.
Atóm vodíka
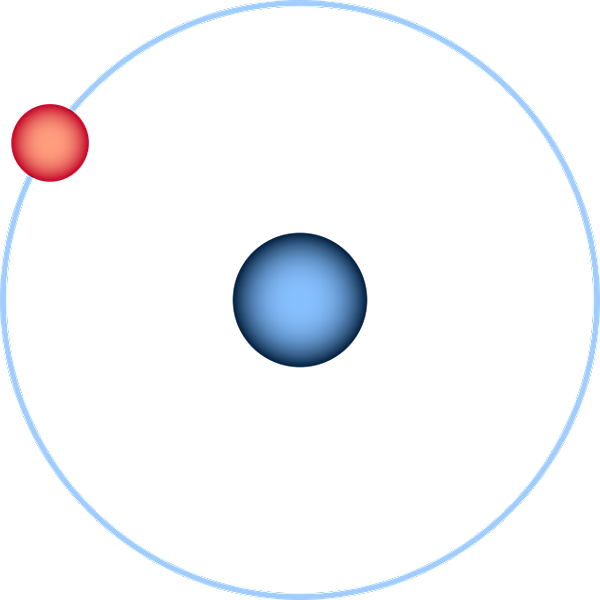 Atóm vodíka predstavoval prostredníctvom modelu Bohra planetárneho modelu. Zdroj: Pixabay.
Atóm vodíka predstavoval prostredníctvom modelu Bohra planetárneho modelu. Zdroj: Pixabay. Atóm vodíka je najjednoduchší zo všetkých a je zvyčajne znázornený ako na vynikajúcom obraze: jadro s osamelým protónom (pre 1H), obklopený elektrónom, ktorý nakreslí obežnú dráhu. Na tomto atóme boli vybudované a odhadované všetky atómové orbitály pre ostatné prvky periodickej tabuľky.
Vernejšou reprezentáciou súčasného chápania atómov by bolo reprezentácia gule, ktorej periféria je definovaná elektronickým a pravdepodobnostným oblakom elektrónu (jeho orbitál 1S).
Môže vám slúžiť: tepelná: štruktúra, charakteristiky, formovanie, príkladyKde je a výroba
 Pole hviezd: nevyčerpateľný zdroj vodíka. Zdroj: Pixabay.
Pole hviezd: nevyčerpateľný zdroj vodíka. Zdroj: Pixabay. Vodík je, aj keď možno v menšej miere v porovnaní s uhlíkom, chemický prvok, ktorý možno povedať bezpochyby, je to všade; Vo vzduchu, okrem vody, ktorá napĺňa moria, oceány a naše telá, v ropnej surovej a minerále, ako aj v organických zlúčeninách, ktoré sú zostavené tak, aby vznikli životnosť.
Stačí na povrchne prezerať na akékoľvek zložené kníhkupectvo, aby v nich našli atómy vodíka.
Otázka nespočí. Napríklad M molekula m2 Je tak prchavá a reaktívna pod výskytom solárnych lúčov, ktoré je v atmosfére veľmi vzácne; Preto reaguje na pripojenie sa k iným prvkom, a tým získava stabilitu.
Zatiaľ čo vyššie, vo vesmíre je vodík prevažne ako neutrálne atómy, h.
V skutočnosti sa vo svojej fáze kovu a kondenzovanej fázy považuje vodík. Ak sú z nich nesmierne množstvo a vďaka ich robustnosti a kolosálnym rozmerom sa z tohto prvku stanú najčastejšími z celého vesmíru. Odhaduje sa, že 75% známej hmoty zodpovedá atómom vodíka.
Prirodzený
Zbierajte atómy voľných vodíkov vo vesmíre znie nemenné a extrahovať ich z periférií slnka alebo hmlisté, nedosiahnuteľné. Na Zemi, kde jeho podmienky nútia tento prvok existovať ako h2, Môže sa vyskytnúť prostredníctvom prírodných alebo geologických procesov.
Napríklad vodík má svoj vlastný prirodzený cyklus, v ktorom ho môžu určité baktérie, mikróby a riasy generovať prostredníctvom fotochemických reakcií. Eskalácia prírodných procesov a paralely na tieto zahŕňa použitie bioreaktorov, kde baktérie sa živia uhľovodíkmi na uvoľňovanie vodíka v nich obsiahnutých.
Živé bytosti sú tiež výrobcami vodíka, ale v menšej miere. Ak áno, nedalo sa vysvetliť, ako predstavuje jedna z plynných zložiek plynalenky; ktoré príliš preukázali, že sú horľavé.
Nakoniec sa oplatí spomenúť, že v anaeróbnych podmienkach (bez kyslíka), napríklad v podzemných vrstvách, môžu minerály pomaly reagovať s vodou za vzniku vodíka. Fayelitaova reakcia to demonštruje:
3fe2SIO4 + 2 h2O → 2 viera3Ani4 + 3 Sio2 + 3 h2
Priemyselný
Zatiaľ čo biohydrogén je alternatívou k vytvoreniu tohto plynu v priemyselných mierkach, najpoužívanejšie metódy sú prakticky „na„ odstránenie “vodíka do zlúčenín, ktoré ho obsahujú, takže ich atómy spájajú a tvoria H2.
Najmenšie environmentálne metódy na jeho produkciu pozostávajú z reagovania koksu (alebo dreveného uhlia) s prehriatou vodnou parou:
C (s) + h2O (g) → CO (g) + h2g)
Podobne sa na tento účel použil zemný plyn:
Chvály4g) + h2O (g) → CO (g) + 3H2g)
A pretože množstvá koksu alebo zemného plynu sú obrovské, je ziskové produkovať vodík pomocou ktorejkoľvek z týchto dvoch reakcií.
Ďalšou metódou na získanie vodíka je aplikovať elektrický šok na vodu na jeho rozloženie vo svojich elementárnych častiach (elektrolýza):
2 h2Alebo (l) → 2 h2g) + alebo2g)
V laboratóriu
V akomkoľvek laboratóriu je možné molekulárny vodík pripraviť v malých množstvách. Na tento účel by sa mal reagovať na aktívny kov so silnou kyselinou, buď v kadičke alebo v skúmavke. Pozorovateľná bublina je jasným znakom tvorby vodíka, ktorý predstavuje nasledujúca všeobecná rovnica:
M (s) + nh+(Ac) → Mn+(Ac) + h2g)
Kde n je kovová valencia. Napríklad horčík reaguje s H+ Na výrobu H2:
Mg (s) + 2h+(Ac) → mg2+(Ac) + h2g)
Reakcie
Reduktor
Samotné oxidačné čísla ponúkajú prvý prístup k tomu, ako sa vodík podieľa na chemických reakciách. H2 Pri reagovaní môže zostať nezmenený alebo rozdeliť na H ióny+ alebo h- v závislosti od toho, aký druh spája; Ak sú viac -menej elektronegatívne ako on.
H2 Je málo reaktívne kvôli sile jeho kovalentnej väzby, H-H; Toto však nie je absolútna prekážka reagovania a tvorby zlúčenín s takmer všetkými prvkami periodickej tabuľky.
Jeho najznámejšou reakciou je reakcia kyslíkového plynu na výrobu výparov vody:
H2g) + alebo2g) → 2h2O (g)
A je to taká afinita k kyslíku, aby vytvorila stabilnú molekulu vody, ktorá s ňou môže dokonca reagovať ako anión alebo2- V určitých oxidoch kovu:
H2g) + cuo (S) → Cu (s) + h2Alebo (l)
Oxid striebra reaguje alebo „redukuje“ rovnakou reakciou:
H2(G) + AUG (S) → Ag (S) + H2Alebo (l)
Tieto vodíkové reakcie zodpovedajú reakciám typu Rédox. To znamená, že oxidácia redukcie. Vodík oxiduje v prítomnosti kyslíka a oxidov kovov menej reaktívnych kovov ako on; Napríklad meď, striebro, volfrám, ortuť a zlato.
Absorpcia
Niektoré kovy môžu absorbovať plynný vodík za vzniku kovových hydrorov, ktoré sa považujú za zliatiny. Napríklad prechodné kovy, ako napríklad paladium, absorbujú notorické množstvá H2, Byť podobný kovovým hukám.
Môže vám slúžiť: Neodymium: Štruktúra, vlastnosti, použitieTo isté sa deje s zložitejšími zliatinami kovov. Týmto spôsobom môže byť vodík uložený inými prostriedkami okrem svojich valcov.
Prírastok
Organické molekuly môžu tiež „absorbovať“ vodík prostredníctvom molekulárnych mechanizmov a/alebo rôznymi interakciami.
Pre kovy, H molekuly2 Sú obklopené kovovými atómami vo svojich kryštáloch; Zatiaľ čo v organických molekulách je väzba H-H rozbitá za vzniku iných kovalentných väzieb. Vo formalizovanejšom zmysle: vodík sa absorbuje, ale pridáva sa do štruktúry.
Klasickým príkladom je pridanie H2 na zdvojnásobenie alebo trojnásobné spojenie alkénov alebo alkínov:
C = c + h2 → H-C-C-H
C≡C + H2 → HC = ch
Tieto reakcie sú tiež uvedené názov hydrogenácie.
Tvorba hydros
Vodík reaguje priamo na prvky za vzniku rodiny chemických zlúčenín nazývaných hydros. Existujú hlavne dva typy: salinos a molekulárne.
Existujú tiež kovové hydrory, ktoré pozostávajú z kovových zliatin už uvedených, keď tieto kovy absorbujú plynný vodík; a polymérny, so sieťami alebo reťazcami väzieb E-H, kde označuje chemický prvok.
Salinos
V soľných hydroroch sa vodík podieľa na iónovej väzbe, ako je hydrid anión, h-. Aby sa to vytvorilo, prvok musí byť nevyhnutne menej elektronegatívny; Inak by sa nevzdal svojich elektrónov vodíku.
Preto sa slané hydrosy tvoria iba vtedy, keď vodík reaguje s veľmi elektropozitívnymi kovmi, ako sú alkalické a alkalinery.
Napríklad vodík reaguje s kovovým sodíkom, aby sa produkoval hydrid sodný:
2na (s) + h2(g) → 2NAH (s)
Alebo s bártnou farbou na výrobu hydrid bárnatého:
BA (s) + h2g) → bah2(S)
Molekulárny
Molekulárne hydridy sú ešte lepšie známe ako iónové. Dostávajú tiež názov vodíka halogenurí, HX, keď vodík reaguje s halogénom:
Cl2g) + h2(G) → 2HCl (G)
Tu sa vodík podieľa na kovalentnej väzbe ako H+; Pretože rozdiely medzi elektronegativitami medzi oboma atómami nie sú príliš veľké.
Rovnaká voda sa môže považovať za kyslíkový hydrid (alebo oxid vodíka), ktorého formovacia reakcia už bola vystavená. Veľmi podobná je reakcia so síry na poskytnutie sírovodíka, páchnuceho plynu:
S (s) + h2g) → H2S (g)
Ale zo všetkých molekulárnych hydrorov najslávnejším (a možno najťažšie syntetizáciou) je amoniak:
N2g) + 3H2g) → 2nh3g)
Žiadosti
V predchádzajúcej časti sa už riešilo jedno z hlavných použití vodíka: ako surovina na vývoj syntézy, anorganických alebo organických materiálov. Ovládanie tohto plynu má zvyčajne iný účel, ako zabezpečiť, aby reagoval na vytvorenie iných zlúčenín odlišných od tých, ktoré boli extrahované.
Surový materiál
- Je to jeden z reagencií syntézy amoniaku, ktorý má následne nekonečné priemyselné aplikácie, počnúc vypracovaním hnojív, až do materiálu pre dusičné lieky.
- Zámerom je reagovať s oxidom uhoľnatého, a tak produkovať metanol, činidlo s vysokým obsahom biopalív.
Redukčné činidlo
- Je to redukčné činidlo určitých oxidov kovov, takže sa používa pri metalurgickej redukcii (už je vysvetlené v prípade meďnatého a iných kovov).
- Znížte tuky alebo oleje na výrobu margarínu.
Ropný priemysel
V ropnom priemysle sa vodík používa na „hydrotratar“ ropnú surovú v vylepšeniach procesov.
Napríklad sa snaží fragmentovať veľké a ťažké molekuly v malých molekulách as väčším dopytom na trhu (Hydrochracheus); uvoľňované kovy zachytené v petroporpirínových klietkach (hydrodesmetalizácia); eliminujte atómy síry ako H2S (Hydrodesulfurizácia); Alebo znížte dvojité odkazy a vytvorte bohaté zmesi v parafínoch.
Palivo
Samotný vodík je vynikajúcim palivom pre rakety alebo kozmickú loď, pretože malé množstvá reagujú s kyslíkom, uvoľňujú obrovské množstvo tepla alebo energie.
V menšom meradle sa táto reakcia používa na návrh buniek alebo vodíkových batérií. Tieto bunky však čelia ťažkostiam, že tento plyn nedokážu správne ukladať; a výzva úplne nezávisle od pálenia fosílnych palív.
Na druhej strane, používaná ako palivo, vodík uvoľňuje iba vodu; Namiesto plynov, ktoré predstavujú prostriedky znečistenia atmosféry a ekosystémov.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Hanyu Liu, Li Zhu, Wenwen Cui a Yanming MA. (s.F.). Teplotné štruktúry tuhého vodíka pri vysokých tlakoch. State Key Lab of Superhard Materials, Jilin University, Changchun 130012, Čína.
- Pierre-Marie Robitaille. (2011). Kvapalný kovový vodík: stavebný blok pre tekuté slnko. Katedra rádiológie, Štátna univerzita v Ohiu, 395 W. 12. Ave, Columbus, Ohio 43210, USA.
- Skupina Bodner. (s.F.). Chémia vodíka. Zdroj: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Vodík. Zdroj: In.Wikipedia.orgán
- Vodíková Európa. (2017). Vodík. Získané z: Hydrogenurope.EÚ
- Foist Laura. (2019). Vodík: Vlastnosti a výskyt. Štúdium. Získané z: štúdie.com
- Jonas James. (4. januára 2009). História vodíka. Zdroj: AltenergyMag.com
- « Bitka Pichincha, príčiny, dôsledky a postavy
- Pastoračné nové charakteristiky, zástupcovia, diela »

