Chemická hybridizácia

- 3607
- 694
- Denis Škriniar
Čo je chemická hybridizácia?
Ten Chemická hybridizácia Je to „zmes“ atómových orbitálov, ktorých koncept predstavil chemik Linus Pauling v roku 1931 s cieľom pokryť nedokonalosti teórie Link Valencie (TEV). Ktoré nedokonalosti? Sú to: molekulárne geometrie a ekvivalentné väzby v molekulách, ako je metán (CH4).
Podľa TEV, v metáne atómové orbitály C formujú štyri σ väzby so štyrmi atómami H. Orbitály 2p, s formami ∞ (dolný obraz) C sú navzájom kolmé, takže H by sa mal od seba odstrániť v uhle 90 °.

Okrem toho 2S (sférický) orbitálny. Experimentálne sa však zistilo, že uhly v chráme4 Sú 109,5 ° a že navyše sú dĺžky odkazov C-H rovnocenné.
Aby sa to vysvetlilo, musí sa zvážiť kombinácia pôvodných atómových orbitálov, aby vytvorila štyri degenerované hybridné orbitály (rovnakej energie). Tu prichádza do hry chemická hybridizácia. Ako sú hybridné orbitály? Závisí to od atómových orbitálov, ktoré ich generujú. Vykazujú tiež zmes týchto elektronických charakteristík.
Spona3
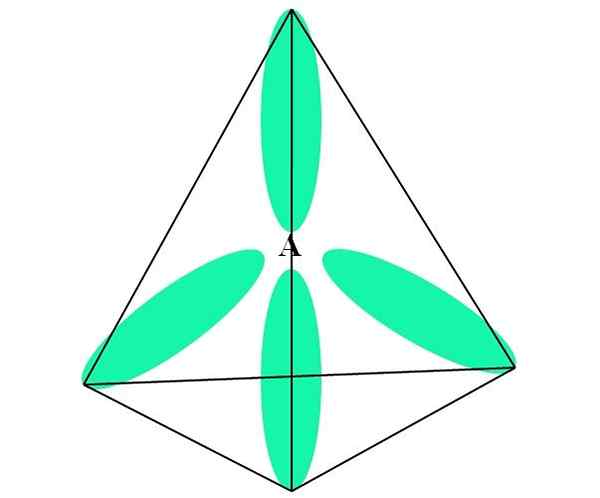
V prípade ch4, C hybridizácia je SP3. Z tohto prístupu je molekulárna geometria vysvetlená štyrmi orbitálmi SP3 oddelené pri 109,5 ° a smerujúce k vrcholom tetraedronu.
Na hornom obrázku vidíte, ako orbitály sp3 (zelená) vytvorenie tetraedrálneho elektronického prostredia okolo atómu (A, ktoré je C pre CH4).
Môže vám slúžiť: amínyPrečo 109,5 ° a nie iné uhly, aby „nakreslil“ inú geometriu? Dôvodom je skutočnosť, že tento uhol minimalizuje elektronické odpudzovanie štyroch atómov, s ktorými sú spojené.
Týmto spôsobom Choova molekula4 Môže byť reprezentovaný ako tetraedron (tetraedrálna molekulárna geometria).
Ak namiesto H, C vytvorila väzby s inými skupinami atómov, aká by bola jeho hybridizácia? Za predpokladu, že uhlíková forma štyri prepojenia σ (C-A), jej hybridizácia bude SP3.
Je možné dôsledne predpokladať, že v iných organických zlúčeninách, ako je napríklad CH3Och, CCL4, C (ch3)4, C6H12 (cyklohexan), atď., Uhlík má hybridizáciu SP3.
Je to nevyhnutné na načrtnutie organických štruktúr, kde uhlíky s jednoduchými odkazmi predstavujú body divergencie; to znamená, že štruktúra nezostane v jednej rovine.
Interpretácia
Aká je najjednoduchšia interpretácia týchto hybridných orbitálov bez riešenia matematických aspektov (vlnové funkcie)? Orbitály SP3 Znamená to, že im vznikli štyri orbitály: jeden s a tri p.
Pretože kombinácia týchto atómových orbitálov by mala byť ideálna, štyri spis orbitály3 Výsledkom je rovnaké a zaberajú rôzne orientácie vo vesmíre (napríklad na orbitáloch PX, pa A pz).
Vyššie uvedené je uplatniteľné pre zvyšky možných hybridácií: Počet hybridných orbitálov je rovnaký ako počet atómových orbitálov, ktoré sa kombinujú. Napríklad orbitál SP Híbridos3d2 Vytvárajú sa zo šiestich atómových orbitálov: jeden s, tri P a dva d.
Odchýlky od uhlov odkazov
Podľa teórie odporu elektronických párov vrstvy Valencie (RPECV) pár voľných elektrónov zaberá viac objemu ako prepojený atóm. To spôsobuje, že odkazy sa pohybujú preč, znižujú elektronické napätie a odklonia uhly 109,5 °:
Môže vám slúžiť: Plavba pre tégliku: Charakteristiky, funkcie, použite príklady
Napríklad v molekule vody sú atómy H spojené s orbitálmi SP3 (v zelenej) a tiež páry elektrónov, ktoré nie sú zdieľané “:„ Zaberajte tieto orbitály.
Odpudky týchto elektrónových párov sú zvyčajne znázornené ako „dva balóny s očami“, čo kvôli ich objemu odrazí tieto dve prepojenia σ o-h.
Vo vode sú teda uhly prepojení skutočne 105 °, namiesto 109,5 ° očakávaných pre tetraedrálnu geometriu.
Aká geometria má potom H2Ani? Má uhlovú geometriu. Pretože? Pretože zatiaľ čo elektronická geometria je tetraedrálna, dva páry zdieľaných elektrónov ju skresľujú na uhlovú molekulárnu geometriu.
Spona2
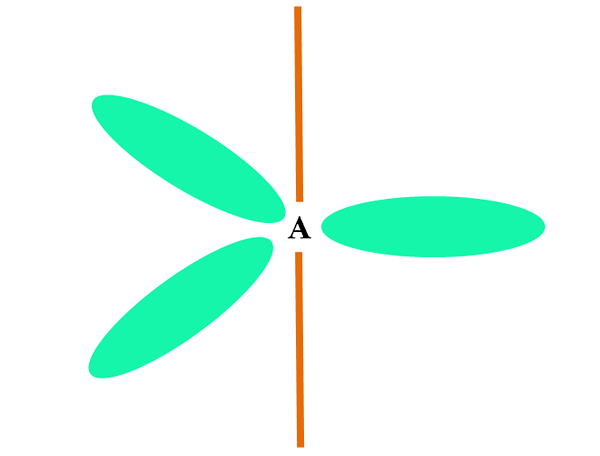
Keď atóm kombinuje dve alebo s orbitály, generuje tri hybridné orbitály SP2; Orbitálna p (pretože existujú tri), zostáva nezmenený, ktorý je znázornený ako oranžová lišta v hornom obrázku.
Tu sú tri orbitály SP2 Sú zelené, aby zdôraznili svoj rozdiel od oranžovej tyče: orbitálna p "čistá".
Atóm s hybridizáciou SP2 Môže sa vizualizovať ako trigonálna plochá podlaha (trojuholník nakreslený pomocou orbitálov SP2 zelená), s jeho vrcholmi oddelenými 120 ° uhlami a kolmi na tyč.
A akú rolu hrá orbitálna čisto čisto? Na vytvorenie dvojitého spojenia (=). Orbitály SP2 Umožňujú tvorbu troch odkazov σ, zatiaľ čo orbitálna čistá väzba P π (dvojité alebo trojité spojenie zahŕňa jedno alebo dve spojenia π).
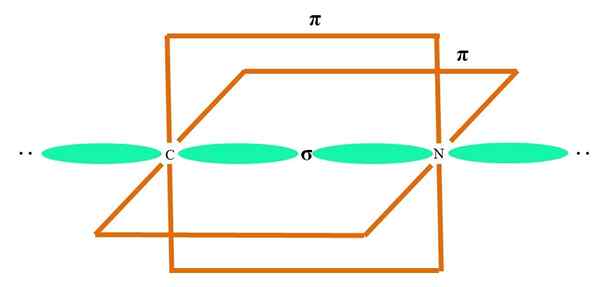
Napríklad nakresliť karbonylovú skupinu a štruktúru molekuly formaldehydu (H2C = o), pokračuje takto:
Môže vám slúžiť: cykopropán (C3H6)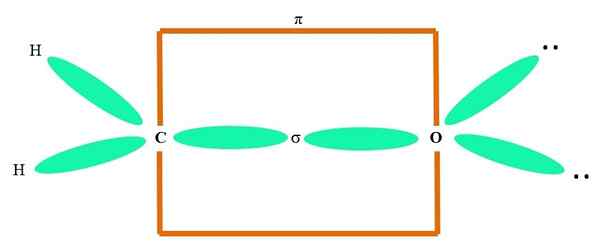
Orbitály SP2 obidva C a O tvoria spojenie σ, zatiaľ čo jeho čisté orbitály tvoria π väzbu (oranžový obdĺžnik).
Je možné si všimnúť, ako sú ostatné elektronické skupiny (atómy H a páry zdieľaných elektrónov) umiestnené v iných orbitáloch SP2, oddelené o 120 °.
Spona
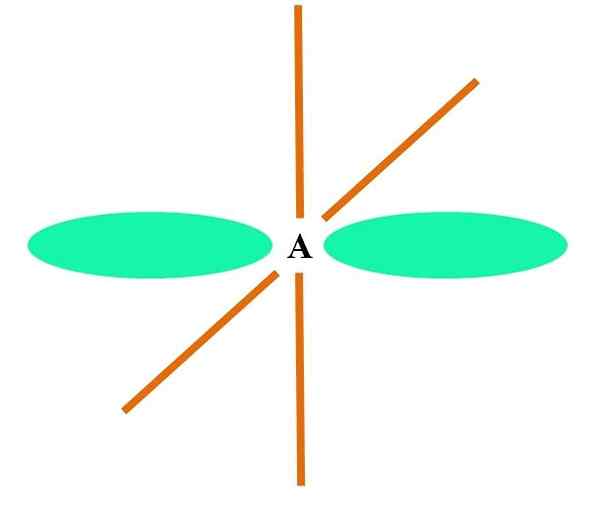
Na vynikajúcom obrázku je atóm ilustrovaný pomocou hybridizácie SP. Tu, orbitál a orbitál P. Dva čisté orbitály sa však teraz nezmenia, čo im umožňuje vytvoriť dva dvojité odkazy alebo trojitý odkaz (≡).
Inými slovami: Ak v štruktúre a C spĺňa vyššie uvedené (= c = o c≡c), potom je jeho hybridizácia SP. Pre ďalšie menej ilustratívne atómy - napríklad prechodné kovy - opis elektronických a molekulárnych geometrií je komplikovaný, pretože orbitály D a dokonca aj F sa považujú za.
Hybridné orbitály sú oddelené pod uhlom 180 °. Z tohto dôvodu sú spojené atómy usporiadané v lineárnej molekulárnej geometrii (B-A-B). Nakoniec na spodnom obrázku je možné vidieť aniónovú štruktúru kyanidu: