Koncept hybridizácie uhlíka, typy a ich vlastnosti
- 1675
- 215
- Denis Škriniar
Ten hybridizácia uhlíka Znamená to kombináciu dvoch čistých atómových orbitálov, aby vytvorili nový „hybridný“ molekulárny orbitál s vlastnými charakteristikami. Pojem atómového orbitálu poskytuje lepšie vysvetlenie ako predchádzajúca koncepcia obežnej dráhy, aby sa stanovila aproximácia, kde je pravdepodobnejšie, že nájde elektrón v atóme.
Inými slovami, atómový orbitál je reprezentácia kvantovej mechaniky, ktorá poskytuje predstavu o polohe elektrónu alebo páru elektrónov v danej oblasti v atóme, kde je každý orbitál definovaný podľa hodnôt jeho hodnoty číselný kvantový.

Kvantové čísla opisujú stav systému (ako je elektrón vo vnútri atómu) v určitom čase prostredníctvom energie patriacej do elektrónu (n), uhlovej hybnosti opisujúcej v jeho pohybe (L), súvisiaci magnetický moment (M) a elektrón sa otáča, zatiaľ čo sa pohybuje vo vnútri atómu.
Tieto parametre sú jedinečné pre každý elektrón v orbitáli, takže dva elektróny nemôžu mať presne rovnaké hodnoty zo štyroch kvantových čísel a každý orbitál môže byť obsadený dvoma elektrónmi vo väčšine elektrónov.
[TOC]
Čo je hybridizácia uhlíka?
Na opis hybridizácie uhlíka by sa malo zohľadniť, že charakteristiky každého orbitálu (jeho tvar, energia, veľkosť atď.) závisí od elektronickej konfigurácie, ktorú má každý atóm.
To znamená, že charakteristiky každého orbitálneho závisia od dispozície elektrónov v každej „vrstve“ alebo úrovni: od najbližšieho k jadru po najvzdialenejšie, známe tiež ako Valencia vrstva.
Môže vám slúžiť: Sodík: História, štruktúra, vlastnosti, riziká a použitieElektróny na najviac vonkajšej úrovni sú jediné, ktoré sú k dispozícii na vytvorenie odkazu. Preto, keď sa vytvorí chemická väzba medzi dvoma atómami, vytvorí sa prekrývanie alebo prekrývanie dvoch orbitálov (jeden z každého atómu), čo úzko súvisí s geometriou molekúl.
Ako je uvedené vyššie, každý orbitál môže byť vyplnený maximom dvoch elektrónov, ale princíp AUFBAU musí vzorku nižšie:

Týmto spôsobom je vyplnená prvá úroveň 1siež, Potom 2siež, nasledované 2p A tak ďalej, v závislosti od toho, koľko elektrónov má atóm alebo ión.
Hybridizácia je teda jav zodpovedajúci molekulám, pretože každý atóm môže prispievať iba čistými atómovými orbitálmi (siež, p, d, F) a z dôvodu kombinácie dvoch alebo viacerých atómových orbitálov sa vytvorí rovnaké množstvo hybridných orbitálov, ktoré umožňujú prepojenia medzi prvkami.
Hybridizácia
Atómové orbitály majú rôzne formy a priestorové orientácie, ktoré zvyšujú zložitosť, ako je to znázornené nižšie:
Zistilo sa, že existuje iba jeden druh orbitálu siež (sférická forma), tri typy orbitálu p (Lobulárny tvar, kde je každý lalok orientovaný na priestorovú os), päť druhov orbitálu d a sedem druhov orbitálu F, kde každý typ orbitálu má presne rovnakú energiu ako energia svojej triedy.
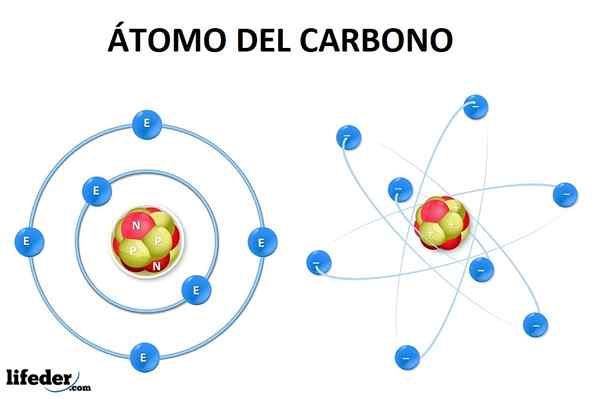
Atóm uhlíka vo svojom základnom stave má šesť elektrónov, ktorých konfigurácia je 1siež22siež22p2. To znamená, že by mali zaberať úroveň 1siež (dva elektróny), 2siež (dva elektróny) a čiastočne 2p (zostávajúce dva elektróny) podľa princípu AUFBAU.
Môže vám slúžiť: alotropiaTo znamená, že atóm uhlíka má iba dva chýbajúce elektróny v orbitáli 2p, Ale nie je možné vysvetliť tvorbu alebo geometriu molekuly metánu (ch4) alebo iné zložitejšie.
Na vytvorenie týchto odkazov je potrebná hybridizácia orbitálov siež a p (V prípade uhlíka), generovanie nových hybridných orbitálov, ktoré dokonca vysvetľujú dvojité a trojité väzby, kde elektróny získavajú najstabilnejšiu konfiguráciu pre tvorbu molekúl.
Spona3
Hybridizácia SP3 Skladá sa z tvorby štyroch „hybridných“ orbitálov z Orbitals 2s, 2pX, 2 Pa a 2pz Čistý.
Preto je na úrovni 2, kde sú k dispozícii štyri elektróny na tvorbu štyroch väzieb a sú paralelné, aby mali menšiu energiu (väčšia stabilita), sú k dispozícii štyri elektróny a sú nariadené, aby mali menšiu energiu (väčšia stabilita).
Príkladom je molekula etylénu (c2H4), ktorých odkazy tvoria 120 ° uhly medzi atómami a poskytujú plochú trigonálnu geometriu.
V tomto prípade sa generujú jednoduché odkazy na C-H a C-C (kvôli orbitálom spona2) a dvojitá väzba C-C (v dôsledku orbitálu p), Na vytvorenie najstabilnejšej molekuly.

Spona2
Prostredníctvom hybridizácie SP2 Tri „hybridné“ orbitály sa generujú z čistého orbitálu 2S. Okrem toho sa získa čistý orbitál, ktorý sa podieľa na tvorbe dvojitého zväzku (nazývaného PI: "π").
Príkladom je molekula etylénu (c2H4), ktorých odkazy tvoria 120 ° uhly medzi atómami a poskytujú plochú trigonálnu geometriu. V tomto prípade sa generujú jednoduché odkazy na C-H a C-C (v dôsledku orbitálov SP2) a dvojitá väzba C-C (v dôsledku orbitálnej p), za vzniku najstabilnejšej molekuly.
Môže vám slúžiť: Chemické reakcie: Charakteristiky, časti, typy, príklady Spona
Spona
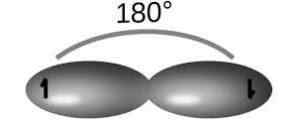
Prostredníctvom hybridizácie SP sú dva „hybridné“ orbitály stanovené z čistého orbitálneho orbitálu 2S. Týmto spôsobom tvoria dve čisté orbitály, ktoré sa zúčastňujú na vytvorení trojitého odkazu.
Pre tento typ hybridizácie, molekula acetylénu (C2H2), ktorého odkazy tvoria 180 ° uhly medzi atómami a poskytujú lineárnu geometriu.
Pre túto štruktúru existujú jednoduché odkazy na C-H a C-C (v dôsledku orbitálov SP) a trojitý odkaz C-C (to znamená dve PI väzby v dôsledku orbitálov P), aby sa získala konfigurácia s menším elektronickým odpudením.

Odkazy
- Orbitálna hybridizácia. Získaný z.Wikipedia.orgán
- Líška, m. Do., A Whitsell, J. Klimatizovať. (2004). Organická chémia. Zotavené z kníh.Riadenie.co.ísť
- Carey, f. Do., a Sundberg, r. J. (2000). Pokročilá organická chémia: Časť A: Štruktúra a mechanizmy. Zotavené z kníh.Riadenie.co.ísť
- Anslyn, e. Vložka., A Dougherty, D. Do. (2006). Moderná fyzikálna organická chémia. Zotavené z kníh.Riadenie.co.ísť
- Mathur, r. B.; Singh, b. P., A panda, s. (2016). Uhlíkové nanomateriály: syntéza, štruktúra, vlastnosti a aplikácie. Zotavené z kníh.Riadenie.co.ísť
- « Chemické charakteristiky pórovitosti, typy a príklady
- Charakteristiky morfosyntaktickej úrovne a literárne zdroje (príklady) »

