Štruktúra bromidu lítium, vlastnosti, použitia, riziká
- 3842
- 714
- Václav Višňovský
On Bromid lítium Je to neutrálna soľ alkalického kovu, ktorého chemický vzorec je knižnica. Vzorec vyjadruje, že jeho kryštalická tuhá látka sa skladá z liónov+ a br- V pomere 1: 1. Vaše kryštály sú biele alebo ľahké béžové. Je veľmi rozpustný vo vode a tiež je to dosť hygroskopická soľ.
Táto posledná vlastnosť umožňuje jeho použitie ako vysúšanie klimatizačných a chladiacich systémov. Podobne sa od začiatku 20. storočia použil bromid lítium, ktorý sa používa pri liečbe určitých porúch duševného zdravia, čím sa opustil jeho použitie v dôsledku nevhodného používania soli.
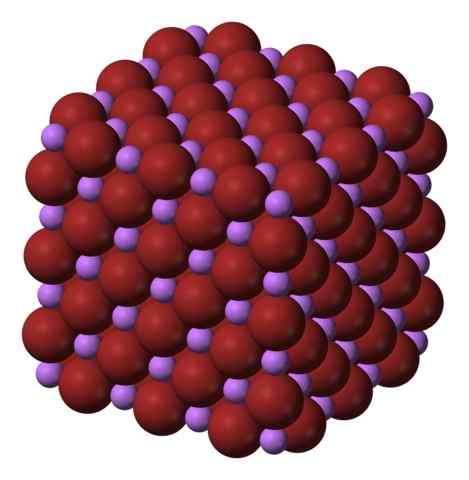
 Kubická kryštalická štruktúra knižnice. Zdroj: Benjah-Bmm27 Via Wikipedia.
Kubická kryštalická štruktúra knižnice. Zdroj: Benjah-Bmm27 Via Wikipedia. LIV sa vyrába spracovaním uhličitanu lítium, li2Co3, s kyselinou bromhyterinovou. Po zahrievaní média sa vyzráža vo vodnom roztoku ako hydrát.
Táto soľ dráždi pokožku a oči kontaktom, zatiaľ čo podráždením respiračných kanálikov inhaláciou. Príjem lítiových solí môže spôsobiť nevoľnosť, zvracanie, hnačku a závraty.
[TOC]
Štruktúra bromidu lítium
Vzorec LIBS objasňuje, že pomer Li/BR sa rovná 1; Pre každú katión Li+ Musí existovať BR anión- náprotivok. Preto musí byť tento pomer udržiavaný konštantný v každom rohu kryštálu LIBR.
Ióny li+ a br- Priťahujú sa navzájom a znižujú odpudky medzi rovnakým zaťažením, aby spôsobili klenot typu kubického kryštálu; Toto je izomorfné pre NaCl (vynikajúci obraz). Všimnite si, že celá sada má kubickú geometriu.
V tomto kryštáli Li+ Sú menšie a majú svetlú fialovú farbu; zatiaľ čo Br- Sú objemnejšie a intenzívnejšie hnedé farby. Zistilo sa, že každý ión má šesť susedov, čo je rovnaké ako tvrdenie, že predstavujú oktaedrálnu koordináciu: knižnicu6 alebo li6BR; Ak sa však uvažuje o jednotnej bunke, pomer Li/BR zostáva 1.
Môže vám slúžiť: kryštalická štruktúraToto je kryštalická štruktúra prijatá, výhodne knižnicou. Môže však tiež tvoriť ďalšie typy kryštálov: wurzita, ak kryštalizuje pri nízkych teplotách (-50 ° C) na substráte; o Kubické sústredené na telo alebo typ CSCL, ak je kubická sklenená soľ vystavená pod vysokým tlakom.
Hydráty
Vyššie uvedené je použiteľné pre bezvodú knižnicu. Táto soľ je hygroskopická, a preto môže absorbovať vlhkosť životného prostredia a rozptýliť molekuly vody do svojich vlastných kryštálov. Takto vznikajú hydráty knihy · nh2Alebo (n = 1, 2, 3 ..., 10). Pre každý hydrát je kryštalická štruktúra iná.
Napríklad kryštalografické štúdie určili, že knižnica · h2Alebo prijať štruktúru typu Perovskita.
Ak sú tieto hydráty vo vodnom roztoku, môžu sa pretekať a vitrifikovať; To znamená, že prijímajú kryštalickú, ale molekulárne nepokojnú štruktúru. Za takýchto podmienok sa mosty vodíka stanú dosť dôležitými.
Vlastnosti
Molekulová hmotnosť
88 845 g/mol.
Vzhľad
Biela kryštalická pevná alebo svetlá béžová.
Vôňa
Záchod.
Bod topenia
552 ° C (1.026 ° F, 825 K).
Bod varu
1.256 ° C (2.309 ° F, 1.538 k).
Rozpustnosť
166,7 g/100 ml pri 20 ° C. Všimnite si svoju vysokú rozpustnosť.
Rozpustnosť v organických rozpúšťadlách
Rozpustný v metanole, etanolu, éteru a acetóne. Mierne rozpustné v pyridíne, aromatickej zlúčenine a menej polárnych ako v predchádzajúcich.
Index lom (ηd)
1 784.
Kaliforka
51,88 j/mol · k.
Štandardná molárna entropia (sθ 298)
66,9 j/mol · k.
zapaľovač
1.265 ° C. Sa považuje.
Stabilita
Stajňa. Forma anhydry je však mimoriadne hygroskopická.
Rozklad
Keď sa rozkladá otepľovaním, spôsobuje oxid lítia.
Môže vám slúžiť: kyselina chlorogenovápH
Medzi pH 6 a 7 vo vodnom roztoku (100 g/l, 20 ° C).
Reaktivita
Bromid lítium nie je reaktívny za normálnych prostredí. Keď sa však teplota zvyšuje, môžete však zažiť intenzívne reakcie so silnými kyselinami.
Pri rozpustení vo vode dochádza k zvýšeniu teploty, spôsobené negatívnou entalpou hydratácie.
Výroba
LIV sa vyskytuje reakciou hydroxidu lítium alebo uhličitanu lítium s kyselinou bromhyterinovou pri neutralizačnej reakcii:
Li2Co3 + HBR => LIBR +CO2 + H2Ani
Lítiumbromid sa získa ako hydrát. Na získanie bezvodej formy je potrebné zahrievať hydratovanú soľ vo vákuu.
Menovanie
Názov „lítiumbromid“ odvodzuje z kovového halogenidu pomenovaného podľa nomenklatúry zásob. Podľa systematickej nomenklatúry sú lítiové monobromúre rovnako platné, ale menej používané; a litický bromid (jedinečná valencia +1 pre lítium), podľa tradičnej nomenklatúry.
Žiadosti
Zlyhaný
Libra je hygroskopická soľ, ktorá vytvára koncentrovanú soľanku schopnú absorbovať vlhkosť vzduchu v širokom rozsahu teploty. Táto soľanka sa používa ako vysúšanie v klimatizačných a chladiacich systémoch.
Vlákna
Používa sa na zvýšenie objemu vlny, vlasov a iných organických vlákien.
Farmaceutické adukty
LiBer forms adukty s niektorými farmaceutickými zlúčeninami, modulujú jeho pôsobenie. Adukt je kombinácia koordináciou dvoch alebo viacerých molekúl, bez štrukturálnej zmeny ktorejkoľvek zo Spojených molekúl.
Sedatívny
Lítium Bromid sa použil na začiatku ako sedatívum pri určitých duševných poruchách, prestaňte používať v roku 1940. V súčasnosti sa používa uhličitan lítium; Ale v každom prípade je lítium prvkom, ktorý vyvíja terapeutický účinok v oboch zlúčeninách.
Môže vám slúžiť: inštalatérsky oxid (PBO): vzorec, vlastnosti, riziká a použitiaLítium sa používa pri liečbe bipolárnej poruchy, ktorá bola užitočná pri kontrole manických epizód poruchy. Predpokladá sa, že lítium inhibuje aktivitu excitačných neurotransmiterov, ako je dopamín a kyselina glutámová.
Na druhej strane sa zvyšuje aktivita inhibičného systému sprostredkovaného neurotransmiterom gama-amino-butylovej (GABA) (GABA). Tieto akcie by mohli byť súčasťou základu terapeutického pôsobenia lítia.
Riziká
Kontaktujte toxicitu
Kožné podráždenie a senzibilizácia, alergie. Vážne zranenia očí alebo podráždenie očí na dýchacích traktoch, nosných dierkach a krku.
Požitie
Hlavné príznaky v dôsledku príjmu bromidu lítium sú: gastrointestinálne poruchy, zvracanie a nevoľnosť. Medzi ďalšie nepriaznivé účinky na požitie soli patrí agitácia, kŕče a strata vedomia.
Stav známy ako „bromizmus“ sa môže vyskytnúť pri dávke lítium -bromidu väčší ako 225 mg/deň.
V bromizme sa môžu vyskytnúť niektoré z nasledujúcich príznakov a príznakov: zhoršenie akné a strata chuti do jedla, chvenie, problémy s rečou, apatia, slabosť a maniakálne agitácie.
Odkazy
- Chemická formulácia. (2019). Bromid lítium. Získané z: Quimica Formulation.com
- David C. Johnson. (10. júla 2008). Nová objednávka pre lítiumbromid. Povaha. doi.org/10.1038/454174A
- Aayushi Jain & R.C. Dixit. (s.F.). Štrukturálny fázový prechod u bromidu lítium: Vplyv tlaku a teploty. [PDF]. Získané z: NCPCM.v
- Takamuku a kol. (1997). Rôntgenové difrakčné štúdie na roztokoch podchladeného vodného lítiumbromidu a lítium jodidového roztoku. Katedra chémie, vedecká fakulta, Fukuoka University, Nanakuma, Jonan-Ku, Fukuoka 814-80, Japonsko.
- Národné centrum pre biotechnologické informácie. (2019). Bromid lítium. Databáza Pubchem, CID = 82050. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Wikipedia. (2019). Bromid lítium. Zdroj: In.Wikipedia.orgán
- Kráľovská spoločnosť chémie. (2019). Bromid lítium. Chempider. Obnovený z: ChemSpider.com
- « Vlastnosti alkyl halogenuros, získanie, príklady
- Mexiko v 18. storočí akty a sociálno -ekonomické zmeny »

